Kvíz se týká CT zobrazení a CT vyšetření.
Otázky:
Q1: Která z následujících vlastností není vlastností bow tie filtru?
a) Redukuje intenzitu svazku, která dopadá na detektor
b) Dělá šum uniformnější
c) Kolimuje rtg svazek dopadající na pacienta
d) Zvyšuje průměrnou energii dopadajícího svazku
Q2: U typického jednořadého CT skeneru je tloušťka řezu určena:
a) Velikostí ohniska
b) Šířkou rtg svazku
c) Velikosti zeslabující protirozptylové mřížky
d) Šířkou bow tie filtru
Q3: U typického multidetektorového CT skeneru je tloušťka řezu určena:
a) Velikostí ohniska
b) Šířkou rtg svazku
c) Šířkou individuálního detektoru a tím, jsou-li informace sousedních detekčních elementů kombinovány
d) Šířkou bow tie filtru
Q4: u CT skiaskopie se
a) Stůl kontinuálně pohybuje, ale rentgenka je stacionární
b) Stůl je stacionární, ale rentgenka se kontinuálně pohybuje
c) Stůl i rentgenka se kontinuálně pohybují
d) Stůl i rentgenka jsou stacionární
Q5: Které z následujících tvrzení o cone-beam svazku je nepravdivé? Poznámka: Nejedná se o CBCT jako 3D modalitu s flat panel detektorem, ale o tvar rtg svazku, kdy byl vějířový svazek nahrazen tzv. cone-beam svazkem.
a) Cone-beam svazek je na multidetektorových CT
b) U cone-beam CT platí, že periferní (vnější) detektory zachycují zeslabení z několika sousedních řezů
c) Rekonstrukce u cone-beam je jednodušší než u vějířového svazku
d) Cone-beam svazky jsou polychromatické
Q6: Prepacientská filtrace (mezi rentgenkou a pacientem) u multidetektorového CT:
a) Určuje prostorové rozlišení
b) Redukuje tvrdnutí rtg svazku
c) Zvyšuje tvrdnutí rtg svazku
d) Se používá pro tvarování rtg svazku
Q7: Která data jsou filtrována při zpětné filtrované projekcí?
a) Rekonstruovaná obrazová data
b) Projekovaná data
c) Data lokalizačního skenu
d) Koronální nebo sagitální rekonstruované obrazy
Q8: Kvantový šum u CT lze snížit:
a) Menší tloušťkou řezu
b) Zvýšením mA
c) Větší tloušťkou pacienta
d) Snížením kV
Q9: Multidetektorové CT má celkovou kolimaci 16 mm a pohyb stolu 24 mm/rotace. Jaký je pitch faktor?
a) 0,5
b) 0,7
c) 1,0
d) 1,5
Q10: Posune-li se stůl u helikálního skenu o 18 mm/rotace a pitch faktor je 1,2, jaká je celková kolimace svazku?
a) 2,1 mm
b) 21 mm
c) 1,5 mm
d) 15 mm
Q11: Který z následujících kroků zlepší podezřelost léze (bude zřetelnější, o jakou lézi se jedná)?
a) Snížení matice rekonstruovaného obrazu
b) Zmenšení tloušťky rekonstruovaného řezu
c) Snížení mA
d) Zvýšení šířky okna
Q12: Je-li napětí nastaveno na 100 kV, pak:
a) Všechny emitované fotony mají energii 100 keV
b) Průměrná hodnota energie všech fotonů je 10 keV
c) Průměrná energie všech fotonů, které dopadnou na detektor, je 100 keV
d) Maximální energie emitovaných fotonů je 100 keV
Q13: Má-li materiál lineární součinitel zeslabení menší než voda, pak jeho CT číslo bude:
a) Negativní
b) Pozitivní
c) Nelze říct bez znalosti hustoty materiálu
d) Nelze říct bez znalosti chemického složení
Q14: Která z následujících možností neovlivňuje CT číslo voxelu?
a) Šířka okna
b) kV
c) Zeslabení okolní tkáně
d) Konvoluční kernel (filtr)
Q15: Který z typů detektorů se nejčastěji využívá na CT?
a) Scintilační detektory
b) Plynové detektory
c) Kalorimetry
d) Všechny výše uvedené, záleží na výrobci
Q16: Hrubá (raw) CT data:
a) Obsahují odezvy detektorů pro všechny projekce při akvizici
b) Obsahují rekonstrukční data pro různé tloušťky řezů
c) Jsou typicky mnohem menší než rekonstruované obrazy
d) Vypadají jako rozmazaný obraz pacienta
Q17: Které z následujících CT čísel se zobrazí bílou barvou při šířce okna 400 (WW) a středu okna 60 (WC)?
a) CT čísla nad 60 HU
b) CT čísla v rozsahu -140 až +260 HU
c) CT čísla pod -400 HU
d) CT čísla na +260 HU
Q18: Jaký je objem voxelu CT skenu o tloušťce 3 mm a velikosti pixelu 1 mm?
a) 0,3 mm^3
b) 3 mm^3
c) 30 mm^3
d) 0,3 cm^3
Q19: Jaký je rozdíl mezi pixelem a voxelem?
a) Žádný, pouze jiný název
b) Voxel reprezentuje element v pravidelné 3D síti, pixel reprezentuje element v 2D síti
c) Voxely se používají na MR, zatímco pixely na CT
d) Voxely se používají na CT, zatímco pixely na MR
Q20: Který z následujících parametrů při zachování všech ostatních parametrů konstantních zlepší prostorové rozlišení?
a) Zvýšení pitch faktoru
b) Zvýšení tloušťky řezu
c) Zmenšení velikosti ohniska
d) Zvýšení šířky okna
Q21: Jaké je typické in-plane rozlišení (v rovině XY, tj. kolmé na pacienta, axiální rovina) u CT skenu břicha?
a) 0,01-0,05 mm
b) 0,1-1,0 mm
c) 1-5 mm
d) 10-15 mm
Q22: Jaké je typické rozlišení v podélné ose pacienta? (osa Z) u CT skenu břicha?
a) 0,01-0,05 mm
b) 0,1-1,0 mm
c) 1-5 mm
d) 10-15 mm
Q23: Který z následujících parametrů při zachování všech ostatních parametrů konstantních sníží dávku pacientovi?
a) Zvětšení velikosti pacienta
b) Zvýšení mA
c) Zvýšení pitch faktoru
d) Zvýšení počtu řad detektorů
Q24: Pro zlepšení prostorového rozlišení při zachování šumu v CT obraze je potřeba:
a) Zmenšit tloušťku řezu a snížit mA
b) Zmenšit tloušťku řezu a zvýšit mA
c) Zmenšit tloušťku řezu a zvětšit matici
d) Zmenšit tloušťku řezu a zvýšit pitch faktor
Q25: Jaké jsou výhody delší doby CT skenu (prodloužení doby rotace rentgenky v gantry) při zachování všech ostatních parametrů konstantních?
a) Lepší časové rozlišení
b) Lepší rozlišení kontrastu
c) Lepší prostorové rozlišení
d) Šetření rentgenky
Q26: Jakým způsobem lze získat z veličiny CTDI_w veličinu CTDI_vol?
a) Vynásobením číslem 1
b) Vynásobením pitch faktorem
c) Vynásobením 1/pitch faktor
d) Vynásobením skenovanou délkou
Q27: Která kombinace následujících parametrů představuje nejvyšší radiační zátěž pro pacienta?
a) 120 kV; 200 mA; 0,5 s doba rotace; 0,8 pitch faktor
b) 120 kV; 150 mA; 1,0 s doba rotace; 1,0 pitch faktor
c) 90 kV; 150 mA; 1,5 s doba rotace; 1,5 pitch faktor
d) 140 kV; 200 mA; 0,5 s doba rotace; 1,5 pitch faktor
Q28: Jak se liší dentální CBCT od klasického CT skeneru?
a) Rotačním časem
b) FOV (field of view)
c) Rozsahem použitelných kV
d) Všechny možnosti
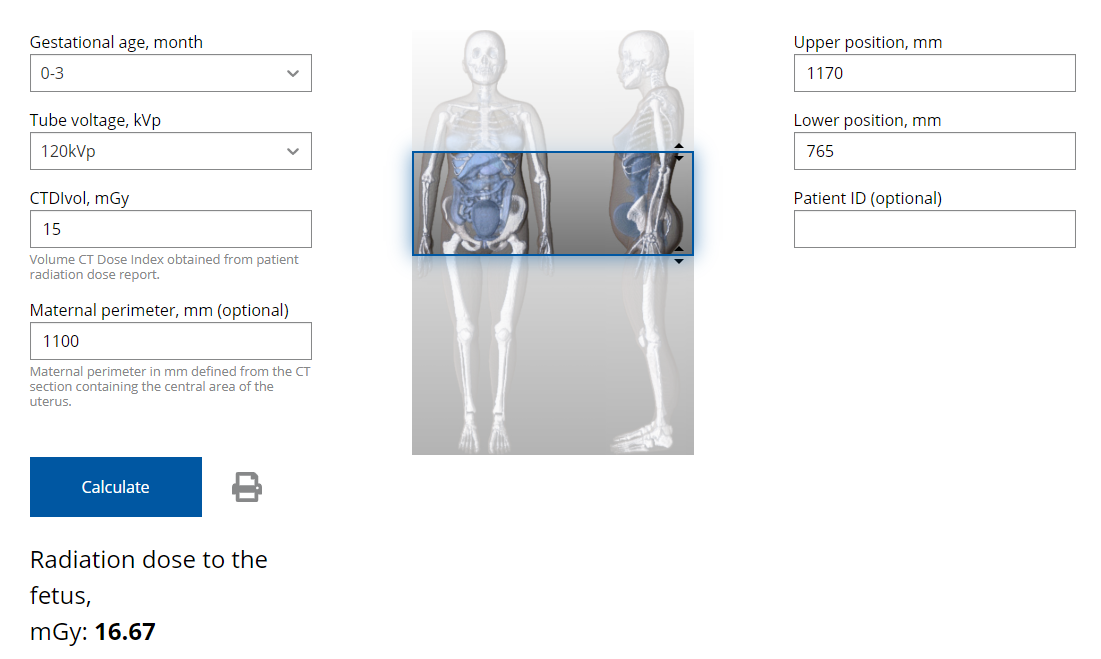
Q29: Jaká je přibližná dávka na plod při CT vyšetření břicha těhotné pacientky (myšleno na jednu fázi)?
a) 0,01-0,05 mGy
b) 0,10-0,50 mGy
c) 1-5 mGy
d) 10-50 mGy
Q30: Jaká je přibližná dávka na kůži při CT vyšetření?
a) 0,03 mGy
b) 0,3 mGy
c) 3 mGy
d) 30 mGy
Odpovědi:
A1: c) Kolimuje rtg svazek dopadající na pacienta
A2: b) Šířkou rtg svazku
A3: c) Šířkou individuálního detektoru a tím, jsou-li informace sousedních detekčních elementů kombinovány
A4: b) Stůl je stacionární, ale rentgenka se kontinuálně pohybuje
A5: c) Rekonstrukce u cone-beam je jednodušší než u vějířového svazku
A6: d) Se používá pro tvarování rtg svazku
A7: b) Projekovaná data
A8: b) Zvýšením mA
A9: b) 1,5 (posun stolu/celková kolimace)
A10: d) 15 mm
A11: b) Zmenšení tloušťky rekonstruovaného řezu
A12: d) Maximální energie emitovaných fotonů je 100 keV
A13: a) Negativní
A14: a) Šířka okna
A15: a) Scintilační detektory
A16: a) Obsahují odezvy detektorů pro všechny projekce při akvizici
A17: d) CT čísla na +260 HU
A18: b) 3 mm^3
A19: b) Voxel reprezentuje element v pravidelné 3D síti, pixel reprezentuje element v 2D síti
A20: c) Zmenšení velikosti ohniska
A21: b) 0,1-1,0 mm
A22: c) 1-5 mm
A23: c) Zvýšení pitch faktoru
A24: b) Zmenšit tloušťku řezu a zvýšit mA
A25: d) Šetření rentgenky
A26: c) Vynásobením 1/pitch faktor
A27: b) 120 kV; 150 mA; 1,0 s doba rotace; 1,0 pitch faktor (závislost je kV^2*mAs*1/pitch)
A28: d) Všechny možnosti
A29: d) 10-50 mGy
A30: d) 30 mGy







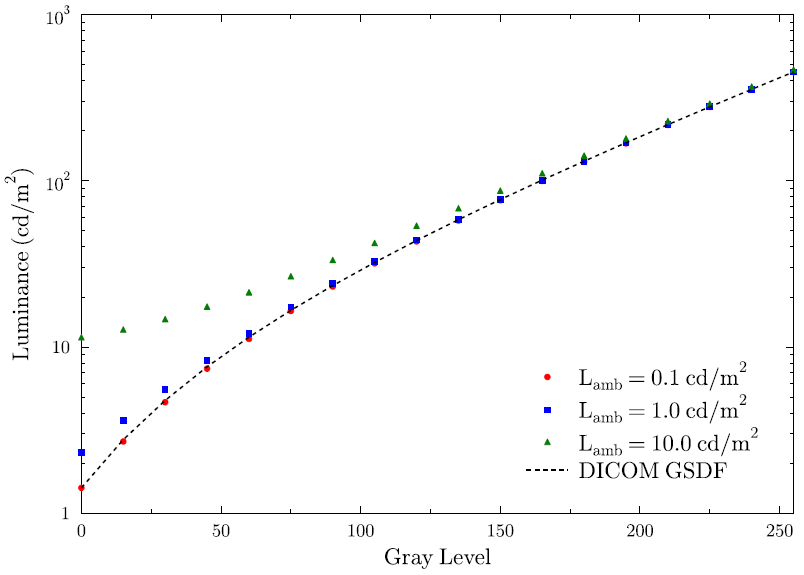
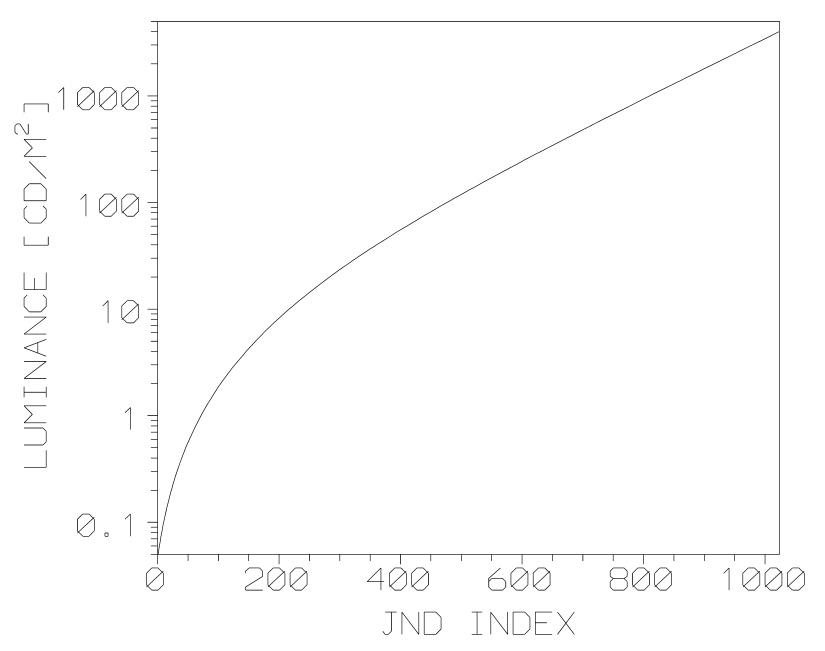
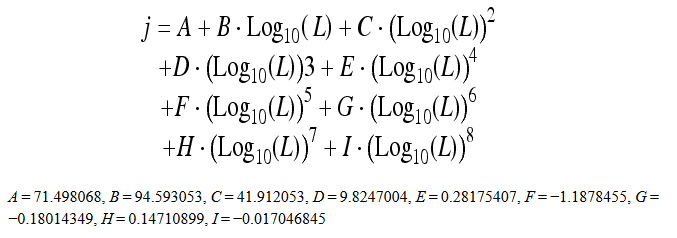
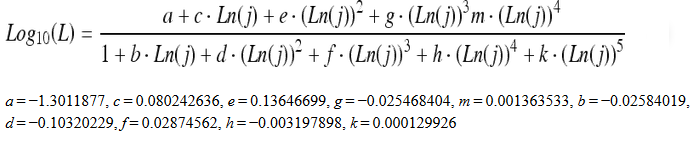
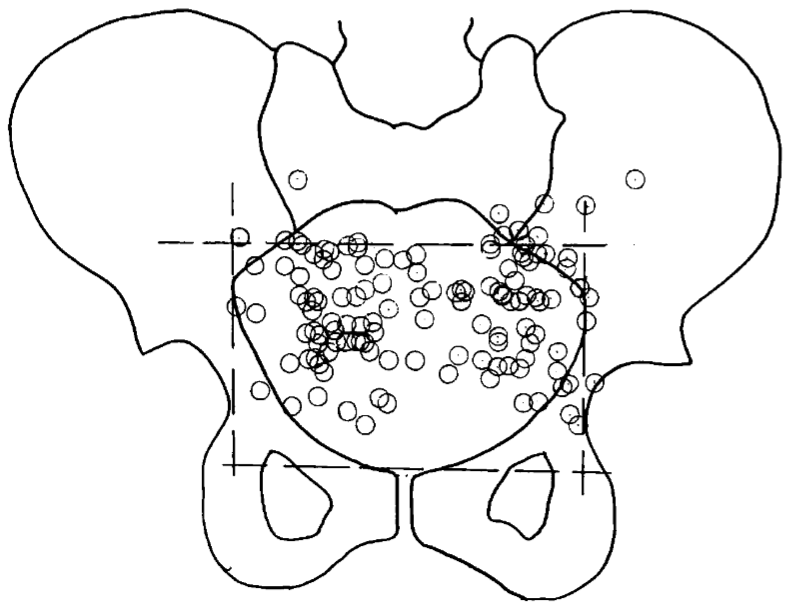 Obr. 1: Pozice vaječníků u 70 žen [2]
Obr. 1: Pozice vaječníků u 70 žen [2]
 Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]
Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]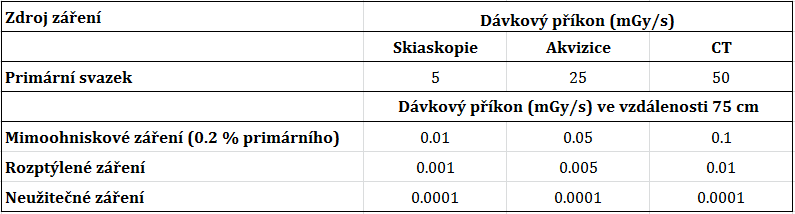 Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]
Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]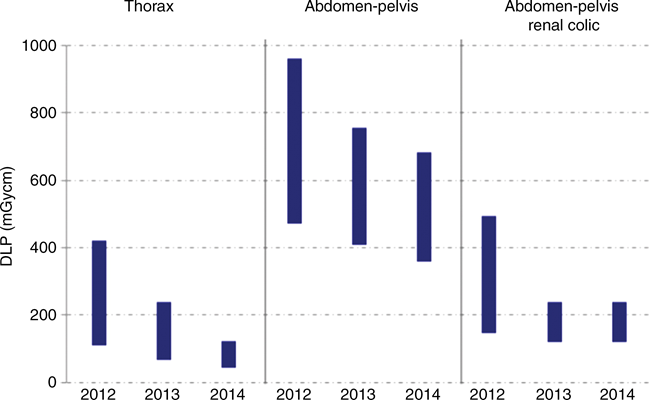 Obr. 1: Porovnání DLP hodnot v čase pro různé vyšetřovací protokoly
Obr. 1: Porovnání DLP hodnot v čase pro různé vyšetřovací protokoly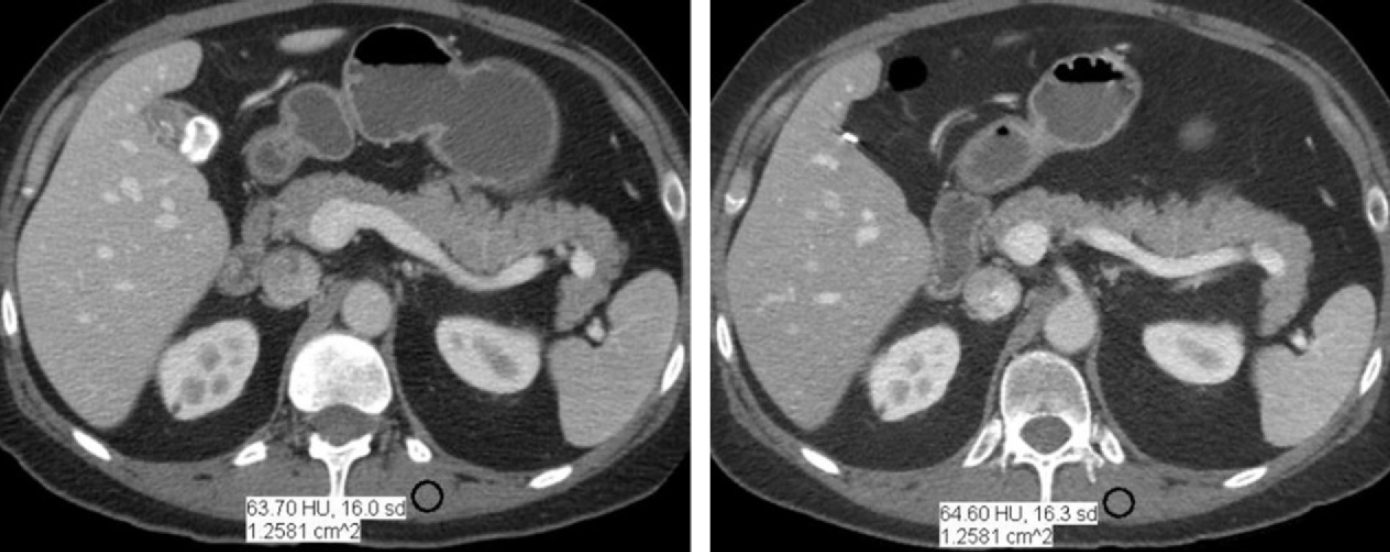 Obr. 1: CT obrazy rekonstruované filtrovanou zpětnou projekcí (nahoře vlevo) a ASIR rekonstrukcí se sílou 30 % (nahoře vpravo), 70 % (dole vlevo) a 100 % (dole vpravo) [1]
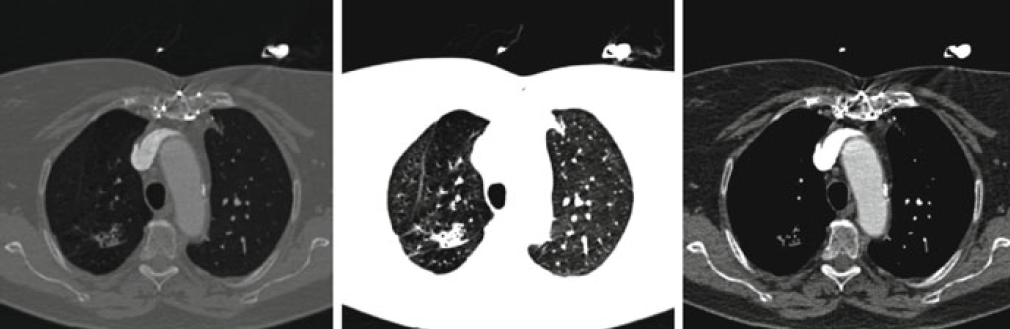
Obr. 1: CT obrazy rekonstruované filtrovanou zpětnou projekcí (nahoře vlevo) a ASIR rekonstrukcí se sílou 30 % (nahoře vpravo), 70 % (dole vlevo) a 100 % (dole vpravo) [1]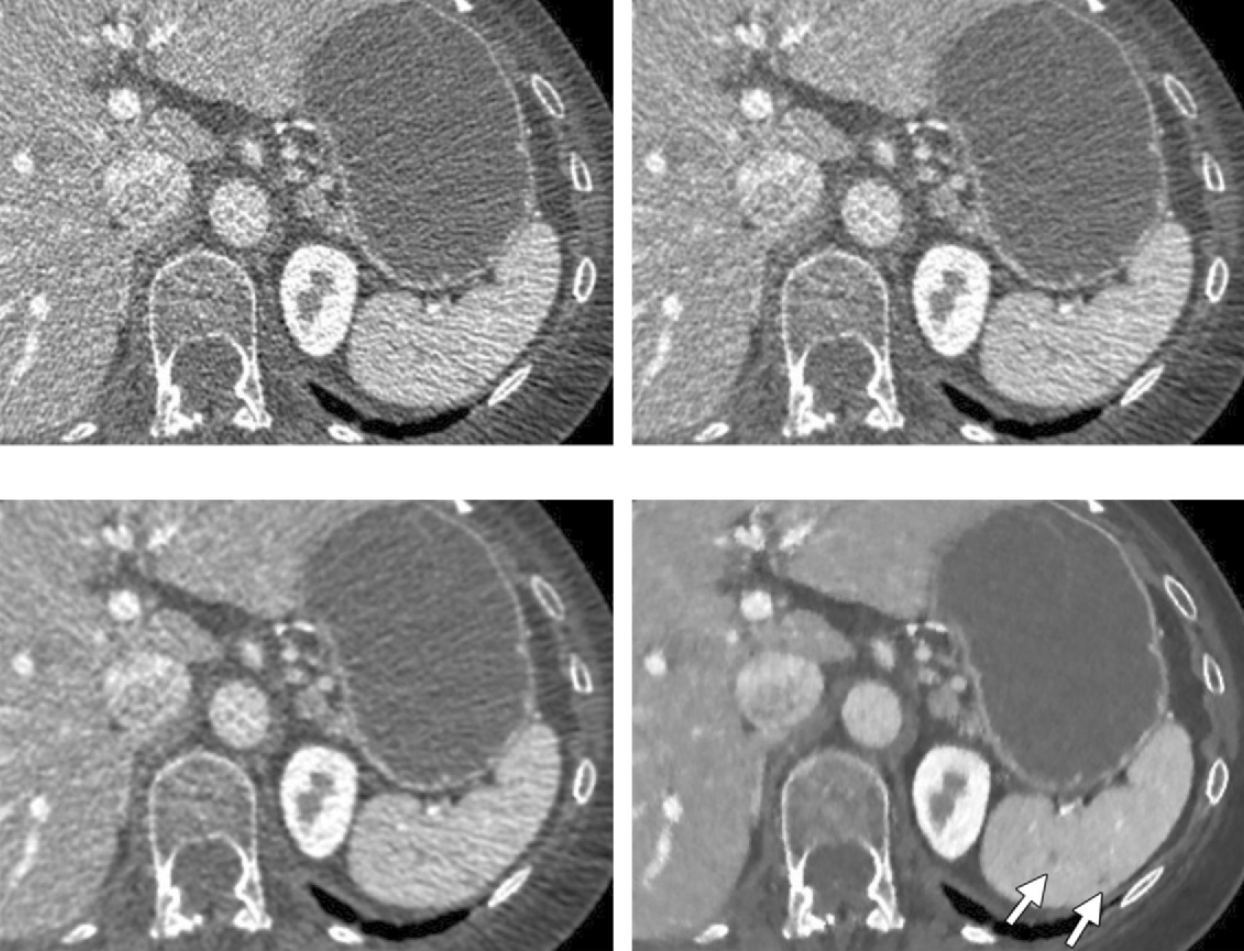 Obr. 3: CT obraz rekonstruovaný filtrovanou zpětnou projekcí (nahoře vlevo), ASIR rekonstrukcí se sílou 50 % (nahoře vpravo), ASIR rekonstrukcí se sílou 100 % (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]
Obr. 3: CT obraz rekonstruovaný filtrovanou zpětnou projekcí (nahoře vlevo), ASIR rekonstrukcí se sílou 50 % (nahoře vpravo), ASIR rekonstrukcí se sílou 100 % (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]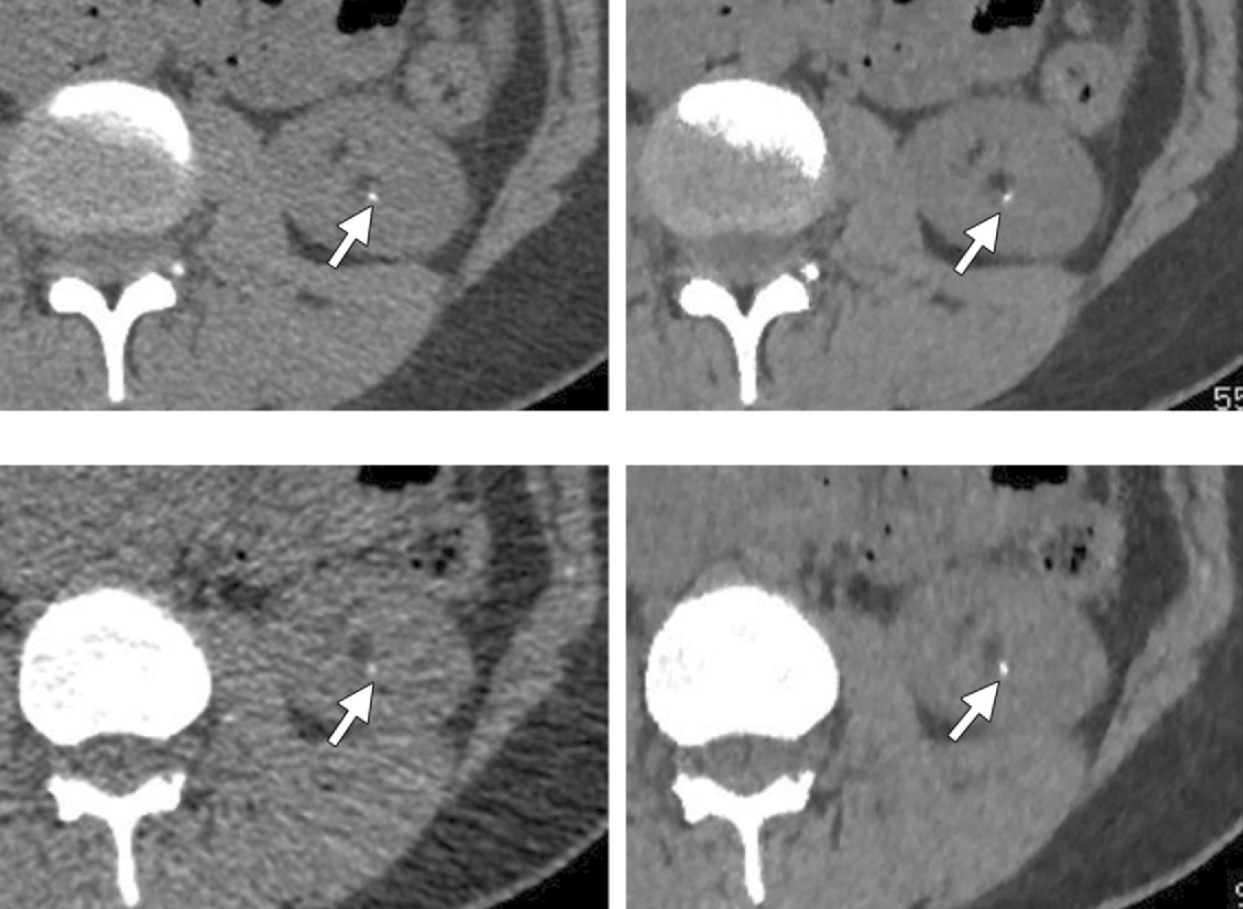 Obr. 4: CT obrazy pořízené s CTDI_vol = 3,57 mGy a zrekonstruované ASIR rekonstrukcí (nahoře vlevo) a MBIR rekonstrukcí (nahoře vpravo) a obrazy pořízené s dávkou CTDI_vol = 0,9 mGy zrekonstruované ASIR rekonstrukcí (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]
Obr. 4: CT obrazy pořízené s CTDI_vol = 3,57 mGy a zrekonstruované ASIR rekonstrukcí (nahoře vlevo) a MBIR rekonstrukcí (nahoře vpravo) a obrazy pořízené s dávkou CTDI_vol = 0,9 mGy zrekonstruované ASIR rekonstrukcí (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]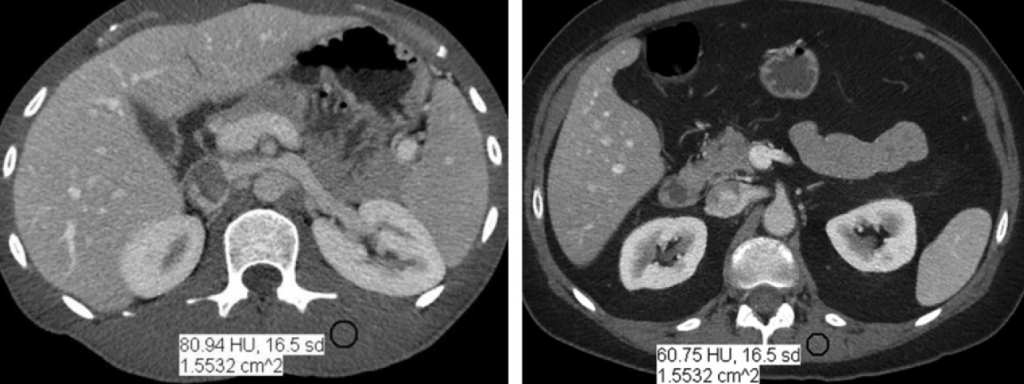 Obr. 1: Axiální CT řezy o stejné tloušťce a stejném indexu šumu 30 pro menšího (vlevo) a většího (vpravo) pacienta [1]
Obr. 1: Axiální CT řezy o stejné tloušťce a stejném indexu šumu 30 pro menšího (vlevo) a většího (vpravo) pacienta [1]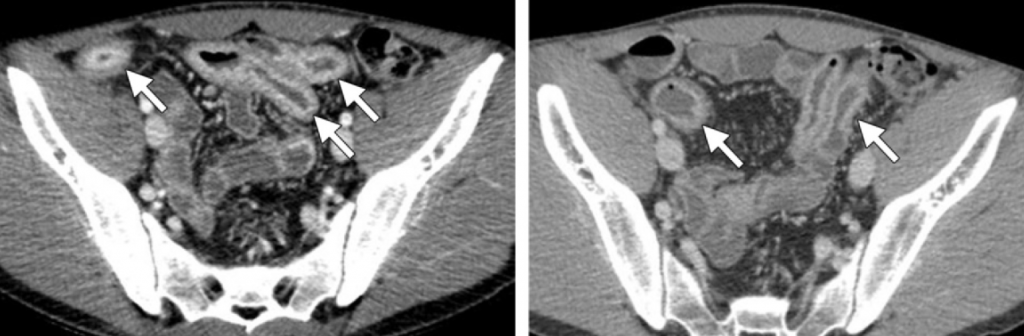 Obr. 2: Axiální CT řezy pořízené při 80 kV (vlevo) a při 120 kV (vpravo) u pacienta s Crohnovou nemocí [1]
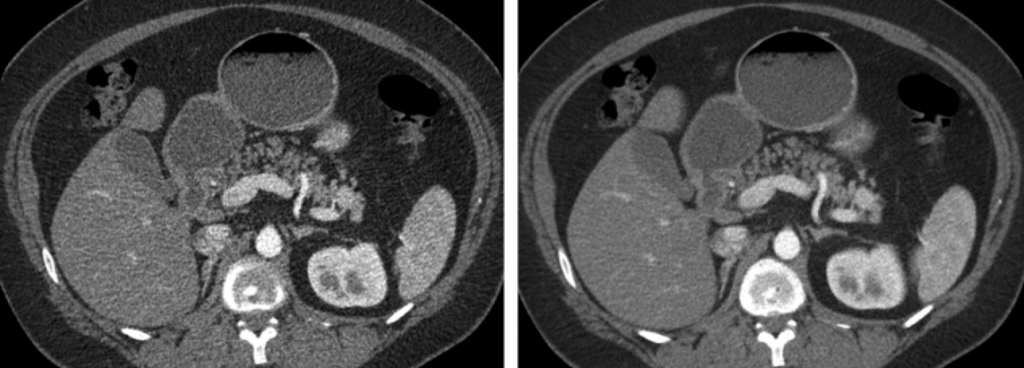
Obr. 2: Axiální CT řezy pořízené při 80 kV (vlevo) a při 120 kV (vpravo) u pacienta s Crohnovou nemocí [1]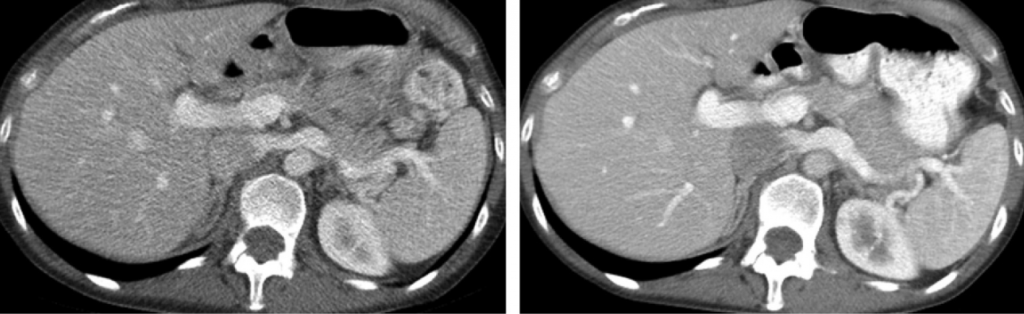 Obr. 1: CT obraz s indexem šumu 35 vlevo (CTDIvol 1,88 mGy) a s indexem šumu 22 vpravo (CTDIvol 4,67 mGy) [1]
Obr. 1: CT obraz s indexem šumu 35 vlevo (CTDIvol 1,88 mGy) a s indexem šumu 22 vpravo (CTDIvol 4,67 mGy) [1]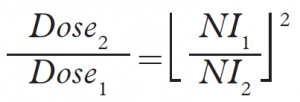
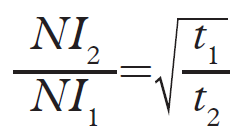
 Obr. 2: CT obrazy s indexem šumu 30 s rekonstruovanou tloušťkou 0,625 mm vlevo a s rekonstruovanou tloušťkou řezu 5 mm vpravo [1]
Obr. 2: CT obrazy s indexem šumu 30 s rekonstruovanou tloušťkou 0,625 mm vlevo a s rekonstruovanou tloušťkou řezu 5 mm vpravo [1]