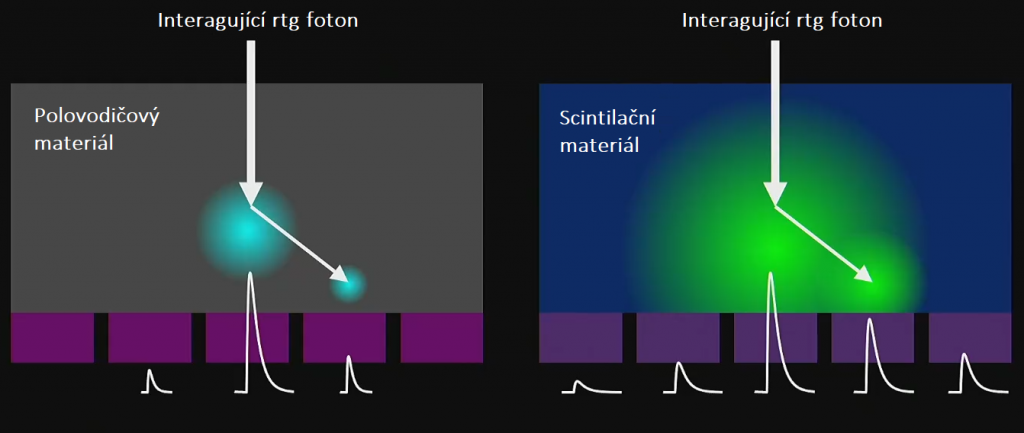
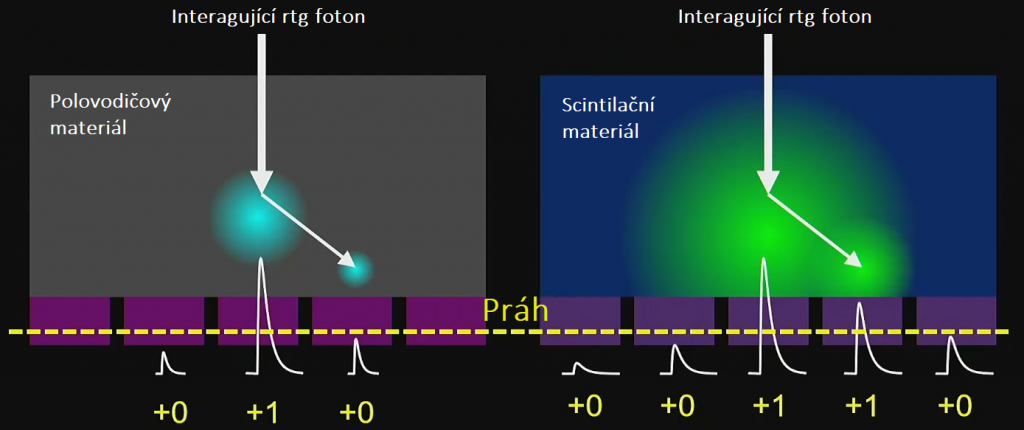
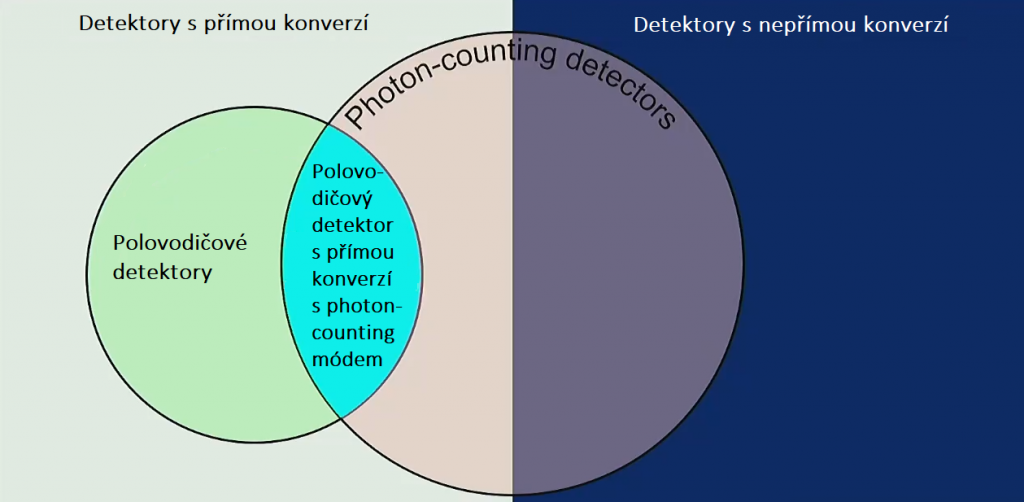
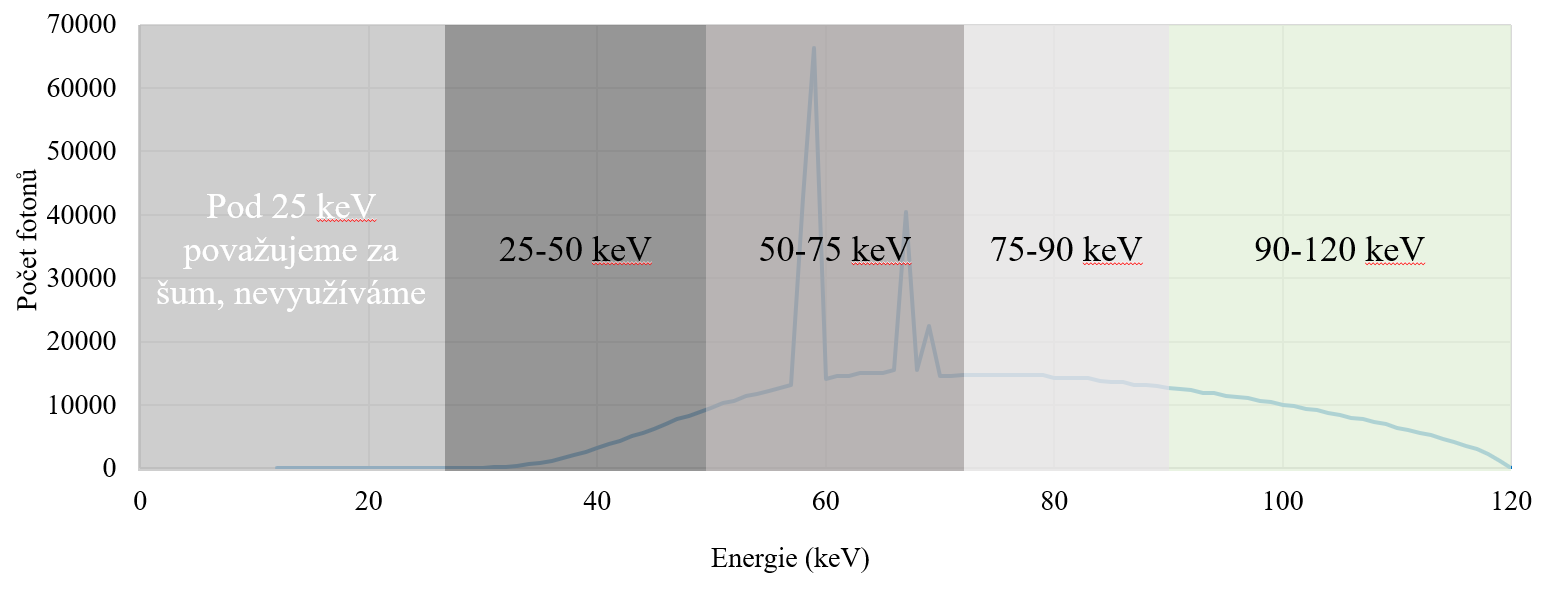
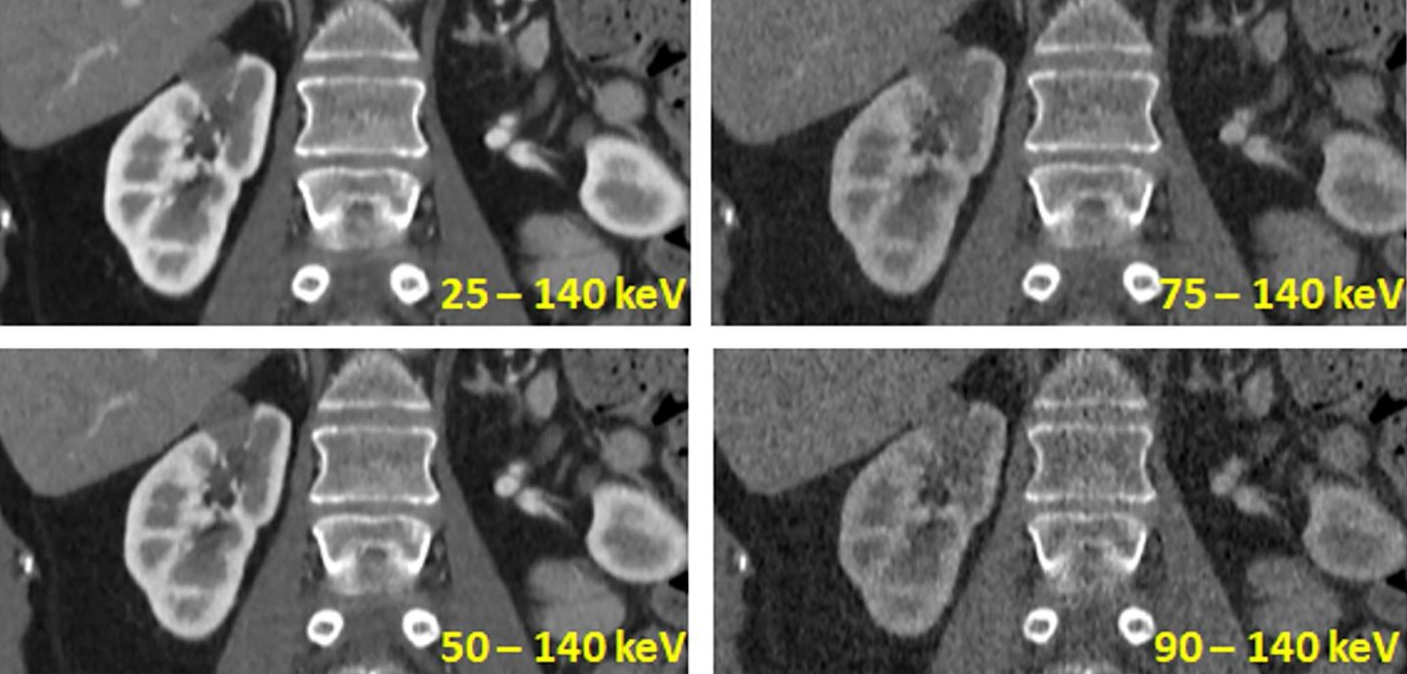
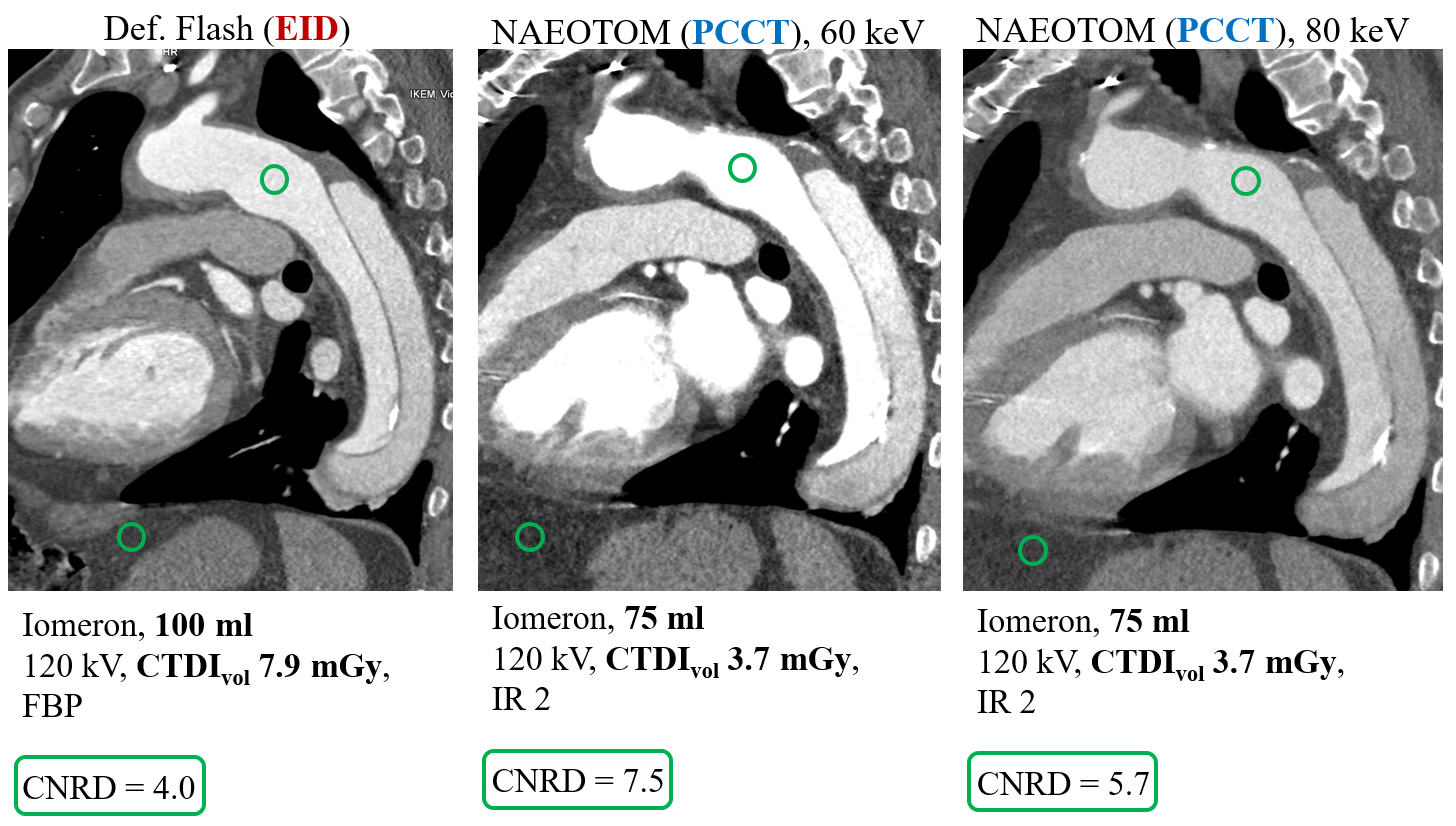
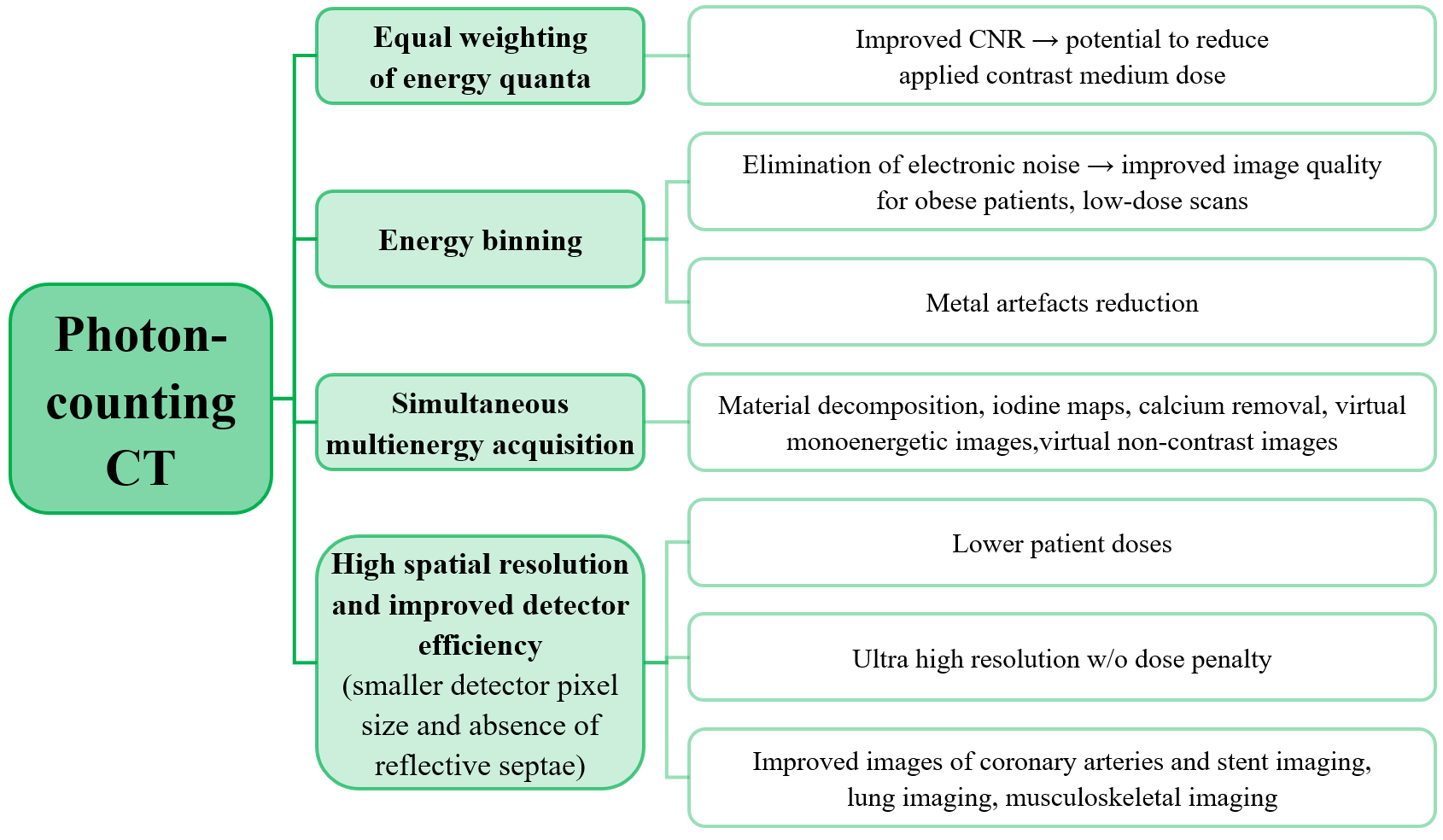
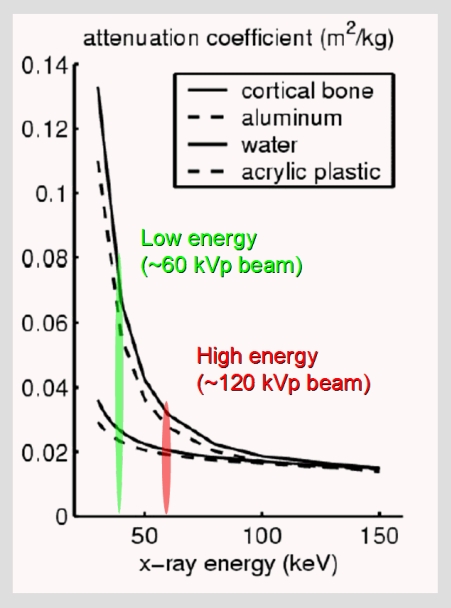
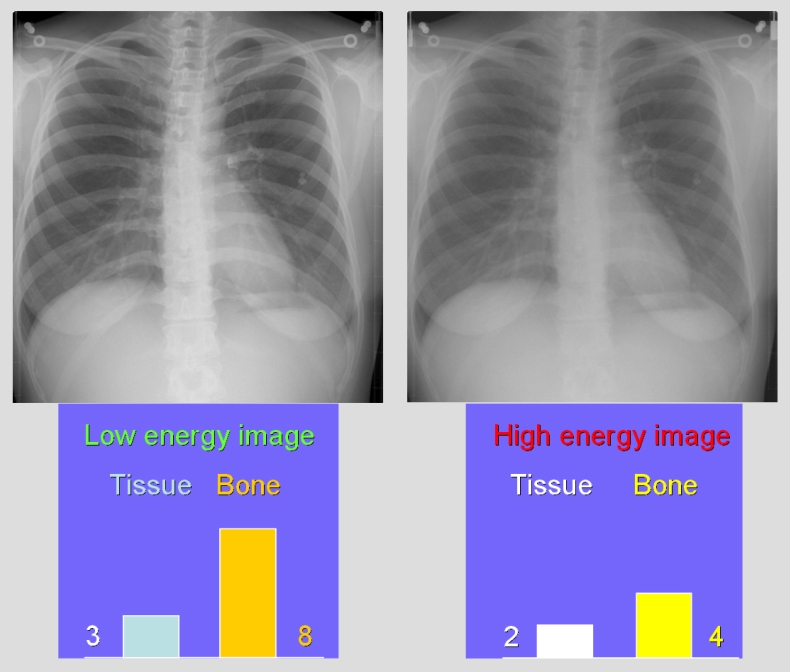
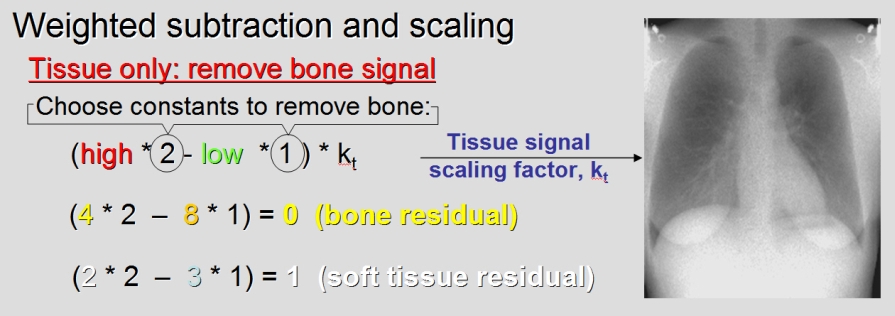
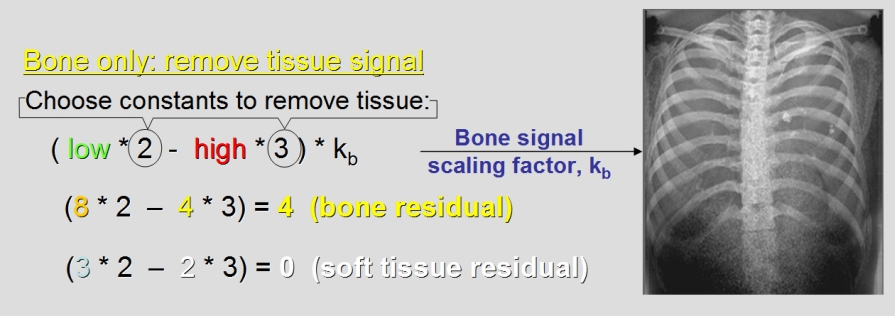
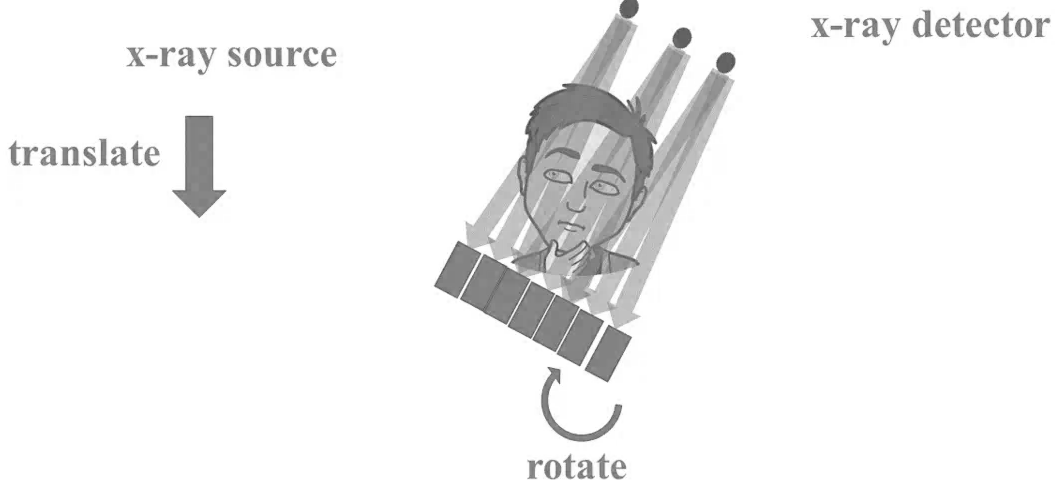
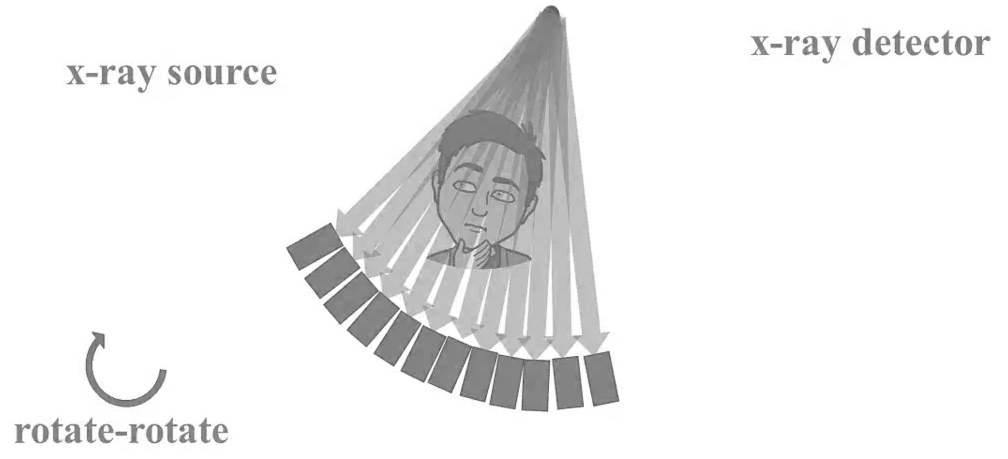
Kvíz se týká tomografického zobrazení – MDCT = multi-detector CT (klasické CT), CBCT = cone-beam CT (angiografické systémy, zubní CBCT).
Otázky:
Q1: Z jak velkého úhlu jsou standardně nabírána data u MDCT (mimo kardiologická vyšetření)?
a) 90°
b) 180°
c) 180° + fan beam
d) 360°
Q2: Z jak velkého úhlu jsou standardně nabírána data u MDCT pro kardiologická vyšetření?
a) 90°
b) 180°
c) 180° + fan beam
d) 360°
Q3: Co mění automatická modulace proudu u MDCT na základě zeslabení pacienta?
a) Dobu rotace
b) Napětí
c) Anodový proud
d) Elektrické množství
Q4: Co mění automatická volba napětí u MDCT na základě zeslabení pacienta?
a) Dobu rotace
b) Napětí
c) Anodový proud
d) Elektrické množství
Q5: Jak společně funguje automatická modulace proudu a automatická volba napětí u MDCT v závislosti na zeslabení pacienta?
a) Po celou dobu skenu se mění proud a napětí
b) Po celou dobu skenu se drží jedna hodnota proudu a mění se napětí
c) Po celou dobu skenu se mění proud a drží se jedna hodnota napětí
d) Po celou dobu skenu se drží jedna hodnota proudu a napětí
Q6: Na základě kterého parametru lze odlišit MDCT od CBCT?
a) U MDCT obíhá rentgenka okolo pacienta o 360°, zatímco u CBCT nikoliv
b) U CBCT je maximální kolimace vždy menší než u MDCT
c) U CBCT je maximální kolimace vždy větší než u MDCT
d) U MDCT je dávka pacientovi vždy nižší než u CBCT
Q7: Jaká je typická doba rotace (s) u MDCT a jaká u CBCT?
a) 0,2-1 s u MDCT, 1-5 s u CBCT
b) 0,2-1 s u MDCT, 5-10 s u CBCT
c) 1-5 s u MDCT, 1-5 s u CBCT
d) 1-5 s u MDCT, 5-10 s u CBCT
Q8: Jak většinou souvisí počet řezů uváděný výrobcem s reálným počtem detektorových řad?
a) Počet řezů ≥ počet detektorových řad
b) Počet řezů = počet detektorových řad
c) Počet řezů ≤ počet detektorových řad
d) Nelze jednoznačně říct
Q9: S menším rekonstruovaným field of view (FoV) dochází v CT obraze ve srovnání s větším rekonstruovaným FoV:
a) Ke snížení šumu
b) Ke zvýšení šumu
c) Žádná změna
d) Nelze obecně říci
Q10: Jaká je přibližně velikost detekčního elementu u MDCT?
a) 0,05-0,1 mm
b) 0,1-0,2 mm
c) 0,2-0,6 mm
d) 0,6-1,0 mm
Q11: Jaká je přibližně velikost detekčního elementu u angiografického CBCT?
a) 0,05-0,1 mm
b) 0,1-0,2 mm
c) 0,2-0,6 mm
d) 0,6-1,0 mm
Q12: Jak je definována velikost detekčního elementu u MDCT?
a) Je to reálná velikost detekčního elementu
b) Je to velikost detekčního elementu ve vzdálenosti 15 cm od izocentra směrem k rentgence
c) Je to velikost detekčního elementu ve vzdálenosti 15 cm od izocentra směrem od rentgenky
d) Je to velikost detekčního elementu v izocentru
Q13: Jak je definována velikost detekčního elementu u CBCT?
a) Je to reálná velikost detekčního elementu
b) Je to velikost detekčního elementu ve vzdálenosti 15 cm od izocentra směrem k rentgence
c) Je to velikost detekčního elementu ve vzdálenosti 15 cm od izocentra směrem od rentgenky
d) Je to velikost detekčního elementu v izocentru
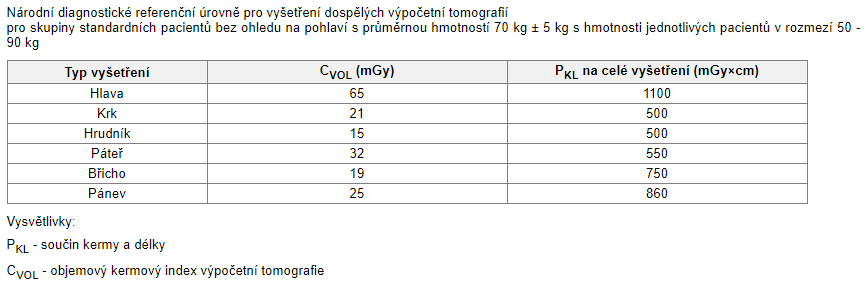
Q14: Množství vyprodukovaného záření na jednu rotaci je u MDCT kvantifikováno pomocí parametru CTDI_vol, který může být stanoven pro malý PMMA fantom o průměru 16 cm nebo pro velký PMMA fantom o průměru 32 cm. Jaký je přibližný vztah mezi CTDI_vol v malém a velkém fantomu při stejných expozičních parametrech?
a) CTDI_vol (malý) ≈ 1/2*CTDI_vol (velký)
b) CTDI_vol (malý) ≈ CTDI_vol (velký)
c) CTDI_vol (malý) ≈ 2*CTDI_vol (velký)
d) CTDI_vol (malý) ≈ 3*CTDI_vol (velký)
Q15: Jak se mění u MDCT s danou referenční kvalitou obrazu a tedy zapnutou automatickou modulací proudu dávka pacientovi (resp. CTDI_vol) v závislosti na rostoucím pitch faktoru?
a) S rostoucím pitch faktorem dávka pacientovi klesá
b) S rostoucím pitch faktorem dávka pacientovi zůstává přibližně stejná
c) S rostoucím pitch faktorem dávka pacientovi narůstá
d) Nelze jednoznačně říci
Q16: Jaký anodový proud bychom museli použít u MDCT skenu s parametry – rotační čas 0,5 s; pitch faktor 1,2; CTDI_vol 0,95 mGy, abychom dostali stejnou kvalitu obrazu jako při skenu s pitch faktorem 0,35; anodovým proudem 35 mA; rotačním časem 0,5 s a CTDI_vol 0,95 mGy?
a) 10 mA
b) 50 mA
c) 120 mA
d) 150 mA
Q17: Existují dva základní přístupy k nastavení automatické modulace proudu. První přístup je, že se CT skener snaží udržet poměr kontrast/šum konstantní. Druhý přístup je, že se zvyšuje akceptovatelný šum s rostoucí velikostí pacienta. Který z přístupů je šetrnější z pohledu dávky pacientovi?
a) První přístup
b) Druhý přístup
c) Nelze jednoznačně říci
Q18: Jaké je vysvětlení druhého přístupu v předešlé otázce? Proč je u větších pacientů akceptovatelnější vyšší šum?
a) Protože si radiolog zvykne
b) Protože to musí tak být kvůli akceptovatelné dávce pacientovi
c) Protože obéznější pacienti obsahují více subkutánního tuku, který lépe odděluje orgány od sebe
d) Protože obéznější pacienti obsahují více viscerálního tuku, který lépe odděluje orgány od sebe
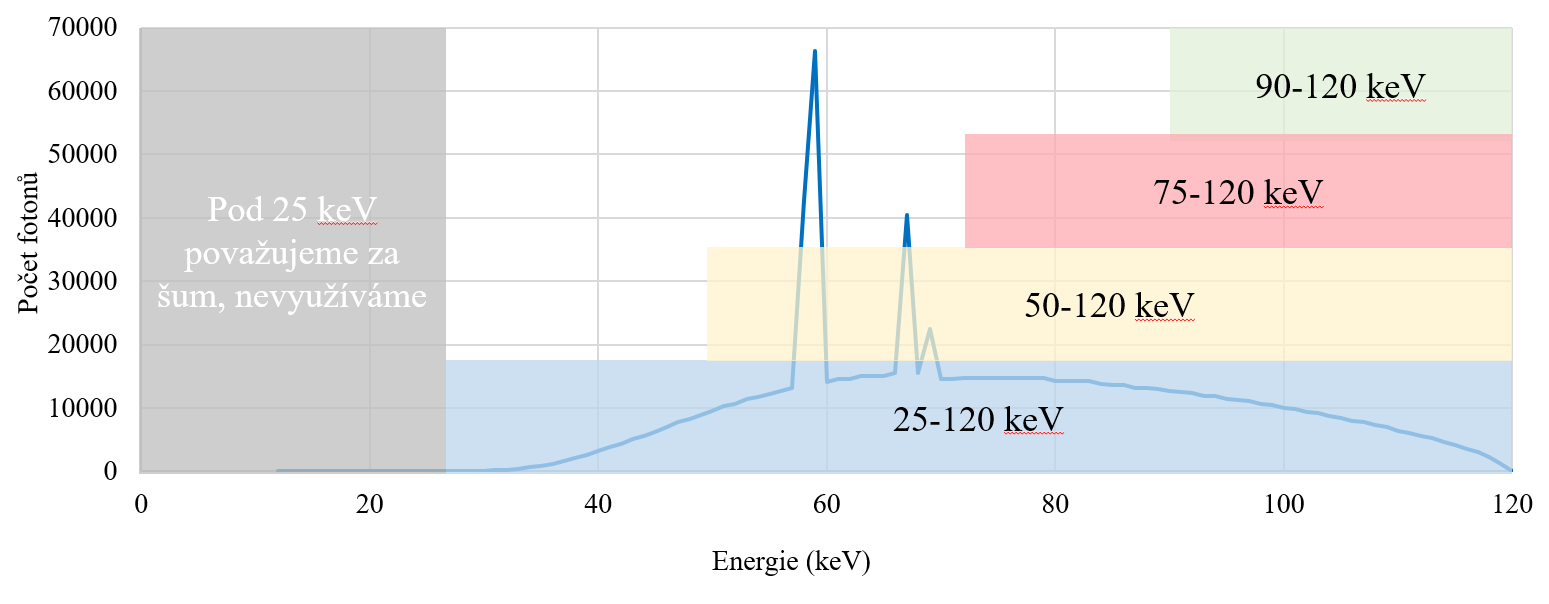
Q19: S měnící se hodnotou napětí u MDCT se mění kvalita obrazu. Jakým způsobem? Doplňte následující tvrzení: S vyšší hodnotou napětí…:
a) Roste kontrast a klesá šum
b) Roste kontrast, ale i šum
c) Klesá kontrast a roste šum
d) Klesá kontrast, ale i šum
Q20: Které z následujících typů MDCT vyšetření bude nejvíce profitovat z nižší hodnoty napětí použitého při CT skenu?
a) Angiografické vyšetření
b) Nativní vyšetření
c) Postkontrastní vyšetření
d) Všechna vyšetření stejně
Q21: Lokalizační sken je možné pořídit v různých projekcích, typicky se využívá AP, ale je možné také PA nebo LAT. Jak ovlivňuje projekce lokalizačního skenu fungování automatické modulace proudu z hlediska hodnoty CTDI_vol u většiny výrobců?
a) Při AP lokalizačním skenu je CTDI_vol nejvyšší
b) Při PA lokalizačním skenu je CTDI_vol nejvyšší
c) Při LAT lokalizačním skenu je CTDI_vol nejvyšší
d) Při kombinaci AP a LAT lokalizačním skenu je CTDI_vol nejvyšší
Q22: Co se děje s kvalitou CT obrazu, je-li průměr vyšetřovaného pacienta větší než maximální velikost rekonstruovaného FoV?
a) Nic, nemá to vliv, hlavně že se pacient vejde do gantry
b) Zhoršuje se – vyšší šum
c) Zhoršuje se – vznik artefaktů
d) Zlepšuje se, protože využíváme větší oblast v gantry
Q23: Jakým způsobem lze redukovat kovové artefakty?
a) Zvýšit napětí a použít algoritmus pro redukci kovových artefaktů
b) Zvýšit napětí a zvýšit proud
c) Zvýšit proud a použít algoritmus pro redukci kovových artefaktů
d) Použít algoritmus pro redukci kovových artefaktů
Q24: Podstupuje-li CT vyšetření obézní pacientka, která má navíc objemná prsa, může se stát, že má prsa po stranách hrudníku, mimo rekonstruované FoV. Jakým způsobem by v takovém případě měl být proveden sken?
a) Nijak, takovou pacientku nevyšetřovat
b) Zvýšit napětí
c) Centrovat pacientku pod izocentrum
d) Doporučit pacientce, aby si vzala podprsenku, aby měla pokud možno co nejvíce kruhový průřez
Q25: Orgánová modulace proudu modifikuje použitý anodový proud v závislosti na projekci. V jakých projekcích (pozicích) rentgenka neprodukuje záření? Projekce (pozice) jsou popsány pomocí ručiček na hodinovém ciferníku.
a) 2-6
b) 6-10
c) 10-2
d) 12-4
Q26: Kterému orgánu lze použitím automatické modulace proudu ušetřit dávku?
a) Plicím
b) Kůži
c) Prsní tkáni
d) Mozku
Q27: U kterých CT výkonů je zpravidla dosahováno vyšší radiační zátěže pacientů, než je obvyklé?
a) CT mozku nativní a kontrastní
b) CT angiografie mozkových tepen
c) Dual energy CT mozku
d) CT perfuze mozku
Q28: Jak se mění CT číslo vody s rostoucí hodnotou napětí?
a) Klesá
b) Roste
c) Zůstává stejné
d) Nelze jednoznačně říct
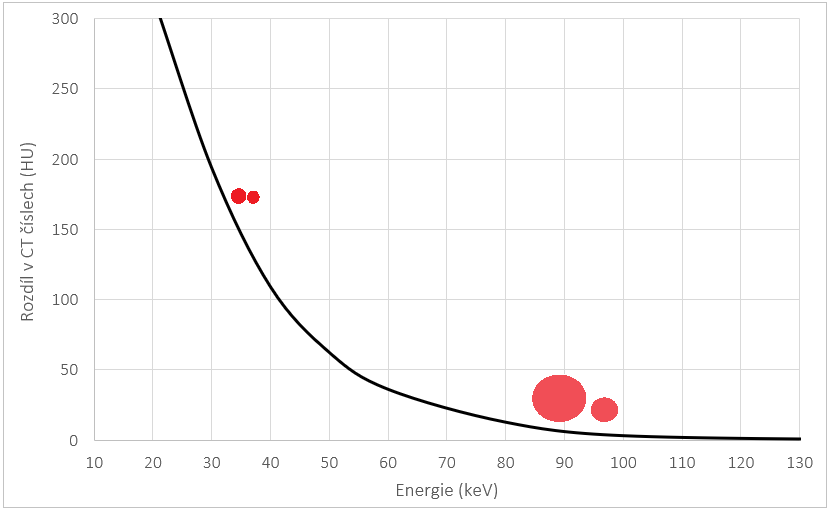
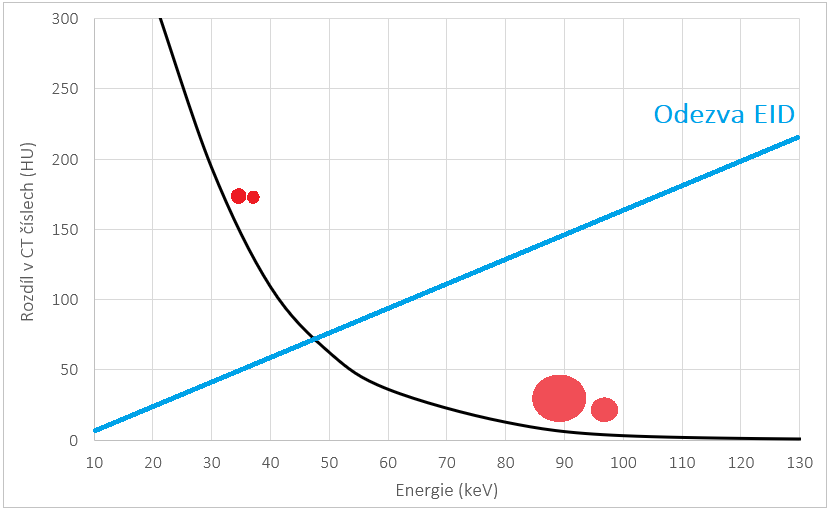
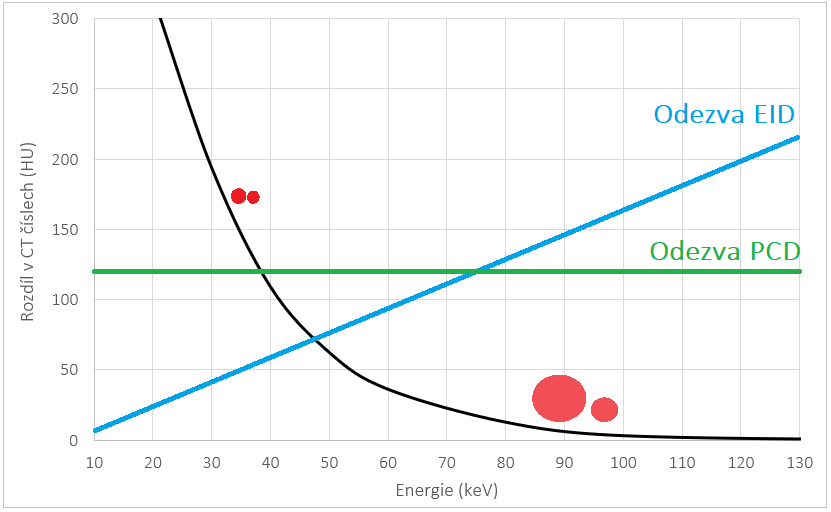
Q29:Jak se mění CT číslo kontrastní látky s rostoucí hodnotou napětí?
a) Klesá
b) Roste
c) Zůstává stejné
d) Nelze jednoznačně říct
Q30: Jak se změní kvalita obrazu, jestliže změníme velikost rekonstruovaného FoV z 20 cm x 20 cm na 35 cm x 35 cm?
a) Zlepší se prostorové rozlišení a sníží se šum
b) Zlepší se prostorové rozlišení, ale zvýší se šum
c) Zhorší se prostorové rozlišení, ale sníží se šum
d) Zhorší se prostorové rozlišení a zvýší se šum
Odpovědi:
A1: d) 360°
A2: c) 180° + fan beam
A3: c) Anodový proud
A4: b) Napětí
A5: c) Po celou dobu skenu se mění proud a drží se jedna hodnota napětí (ačkoliv si spousta lidí myslí, že se mění po celou dobu skenu proud i napětí, tak tomu tak není, mění se pouze proud a hodnota napětí se zvolí na začátku podle lokalizačního skenu a zůstává po celou dobu skenu stejná)
A6: a) U MDCT obíhá rentgenka okolo pacienta o 360°, zatímco u CBCT nikoliv
A7: b) 0,2-1 s u MDCT, 5-10 s u CBCT
A8: a) Počet řezů ≥ počet detektorových řad
A9: b) Ke zvýšení šumu (v každém voxelu je při menším rekonstruovaném FoV méně rtg fotonů, proto vyšší šum)
A10: c) 0,2-0,6 mm
A11: b) 0,1-0,2 mm
A12: d) Je to velikost detekčního elementu v izocentru (takže reálná velikost detekčního elementu o velikosti 0,6 mm v izocentru je při zvětšení 1,5x 0,9 mm)
A13: a) Je to reálná velikost detekčního elementu
A14: c) CTDI_vol (malý) ≈ 2*CTDI_vol (velký)
A15: b) S rostoucím pitch faktorem dávka pacientovi zůstává přibližně stejná
A16: c) 120 mA (jde nám o dosažení stejné hodnoty efektivní mAs = mA*rotační čas/pitch, tedy 35*0,5/0,35 = 50 mAs, pro rotační čas 0,5 s a pitch faktor 1,2 pak musíme použít proud 120 mA)
A17: b) Druhý přístup
A18: d) Protože obéznější pacienti obsahují více viscerálního tuku, který lépe odděluje orgány od sebe
A19: d) Klesá kontrast, ale i šum
A20: a) Angiografické vyšetření
A21: b) Při PA lokalizačním skenu je CTDI_vol nejvyšší (ano, je to tak, existuje celá řada studií, např. Effect of CT Localizer Radiographs on Radiation Dose Associated With Automatic Tube Current Modulation: A Multivendor Study – ScienceDirect, které to dokazují, proto je výhodnější provádět lokalizační sken v AP projekci; v případě dvou lokalizačních skenů by druhý sken měl být v AP projekci)
A22: c) Zhoršuje se – vznik artefaktů
A23: a) Zvýšit napětí a použít algoritmus pro redukci kovových artefaktů
A24: d) Doporučit pacientce, aby si vzala podprsenku, aby měla pokud možno co nejvíce kruhový průřez
A25: c) 10-2 (rentgenka neprodukuje záření v horních 120°)
A26: c) Prsní tkáni
A27: d) CT perfuze mozku
A28: c) Zůstává stejné
A29: a) Klesá
A30: b) Zlepší se prostorové rozlišení, ale zvýší se šum