V posledních letech jsou dost ožehavým tématem dávky z opakovaných radiodiagnostických vyšetření. V tomto případě není opakovanými vyšetřeními myšleno znovuprovedení vyšetření z důvodu např. špatné kvality obrazu, ale situace, kdy pacienti podstupují některá vyšetření opakovaně z důvodu sledování léčby. Touto tématikou se zabýval také virtuální meeting ve dnech 19.-23. 10. 2020 uspořádaný International Atomic Energy Agency. Alespoň některé postřehy bych tu ráda uvedla, ale pro začátek uvedení do problematiky.
Různé studie ohledně kumulativních dávek z opakovaných vyšetření, zejména CT vyšetření, se začaly objevovat už cca před 10 lety, avšak pouze velmi výjimečně. Odhady kumulativních dávek v těchto studiích byly většinou založeny na vynásobení typických dávek počtem vyšetření. Mimo to se objevilo i několik studií, které se zabývaly kumulativními dávkami pro specifická onemocnění, zejména ta, u kterých pacienty často podstupují radiodiagnostické výkony. Typicky se jedná o pacienty s Crohnovou chorobou, s kardiologickým onemocněním, selhávajícími ledvinami, implantovanými stentgrafty atd.
Studie zabývající se kumulativními efektivními dávkami se ve větší míře objevují i dnes, avšak s podstatně přesnějšími odhady kumulativních efektivních dávek. Odhady kumulativních efektivních dávek jsou založeny na dose management softwarech neboli softwarech pro sledování dávek (více např. v příspěvku o CT optimalizaci). Díky těmto softwarům je již možné podstatně jednodušším způsobem určit, která onemocnění jsou spojena s vyššími kumulativními dávkami a také jaké přibližně jsou tyto kumulativní dávky. Do popředí zájmu se pak dostávají pacienti, u nichž je kumulativní efektivní dávka vyšší než 100 mSv.
Dříve se žilo v domnění, že pacienti s kumulativními efektivními dávkami vyššími než 100 mSv jsou spíše pacienti léčení ve speciálních centrech a že jsou to převážně starší pacienti s maligním onemocněním nebo s onemocněním s velmi špatnou prognózou. Takže se této problematice nevěnovala příliš pozornost.
Nové světlo na tuto problematiku vrhly až nedávno publikované studie, za nimiž často stál Madan Rehani, který se v poslední době zabývá osvětou této problematiky. Studie zahrnující CT vyšetření byly provedeny ve spolupráci s různými státy a zdravotnickými zařízeními. Mezi tyto studie patří zejména tři následující:
Zde jsou odkazy ke stažení jednotlivých článků:
Patients undergoing recurrent CT scans: assessing the magnitude (Rehani, M.)
Patients undergoing recurrent CT exams: assessment of patients with non-malignant diseases, reasons for imaging and imaging appropriateness (Rehani, M.)
Multinational data on cumulative radiation exposure of patients from recurrent radiological procedures: call for action (Brambilla, M.)
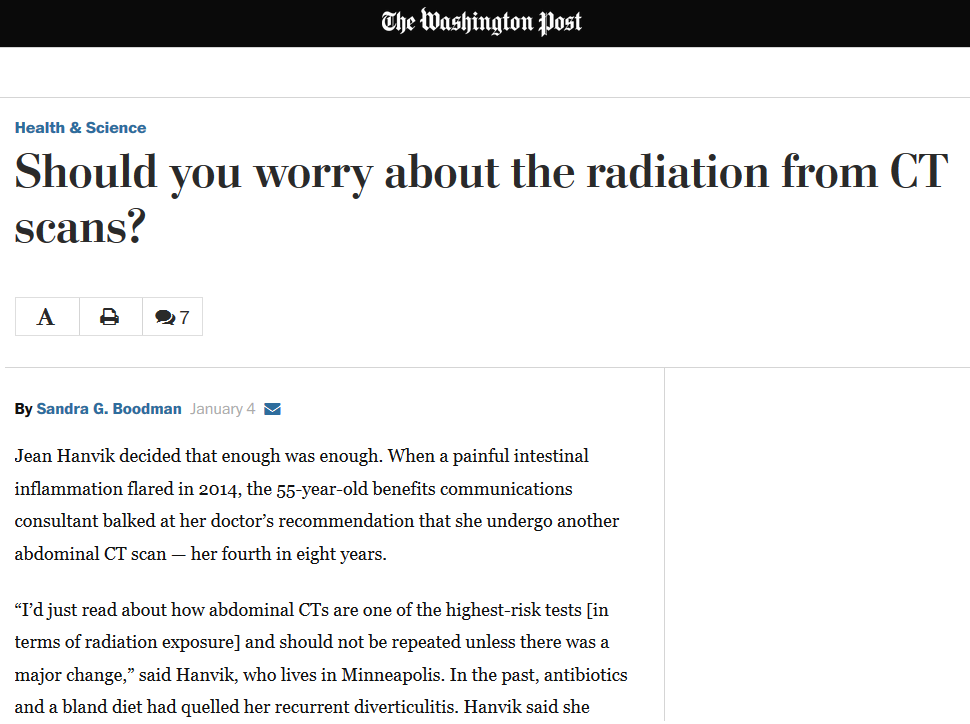
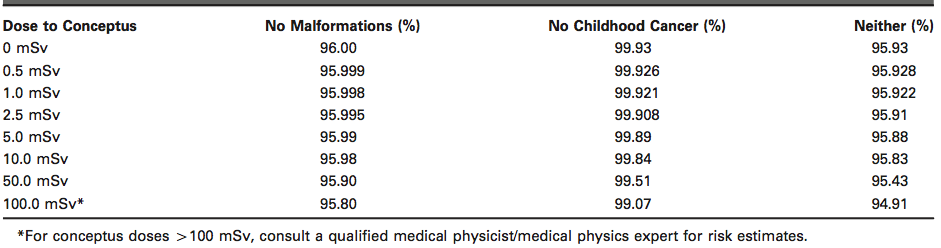
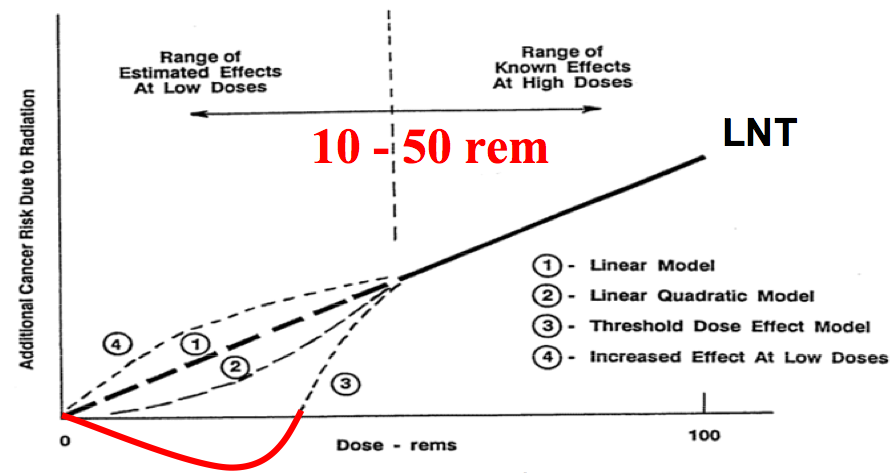
Do studií bylo zahrnuto 344 nemocnic ze 20 zemí, využívající 344 CT skenerů. Sběr dat trval od 1 do 5 let. Zahrnuto bylo 3,3 mil. pacientů (pouze ti, kteří podstoupili CT vyšetření opakovaně, ostatní pacienti zahrnuti nebyli), kteří podstoupili přes 5 mil. CT vyšetření. Ve studiích se řešil počet pacientů, kteří obdrží kumulativní efektivní dávku (CED, cumulative effective dose) vyšší než 100 mSv. Jen pro upřesnění proč zrovna mezní hodnota 100 mSv. Efektivní dávka 100 mSv bývá často označována jako hranice mezi „nízkými“ a „vysokými“ dávkami, u dávek nad 100 mSv byla ve studiích statisticky prokázána vyšší pravděpodobnost vzniku stochastických účinků.
Ze studií vyplynulo, že kumulativní dávku vyšší než 100 mSv obdrží 1,5 % pacientů, pro různé nemocnice se tato hodnota pohybovala mezi 0,6-3,4 % pacientů. V průměru se dá říct, že každý stý pacient obdrží kumulativní dávku z CT vyšetření vyšší než 100 mSv. Maximální počet CT vyšetření na jednoho pacienta byl 109 CT vyšetření, což mi popravdě přijde neuvěřitelné…
Následně Madan Rehani publikoval další článek (viz níže), ve kterém uvádí, že ve 35 zemích OECD se dá předpokládat, že přibližně 2,5 mil. pacientů obdrží kumulativní efektivní dávku vyšší než 100 mSv v průběhu pěti let.
V tomto naposled zmiňovaném článku se objevil odhad počtu pacientů s kumulativní efektivní dávkou vyšší než 100 mSv pro různé země (viz obr. 1), včetně České republiky. V České republice obdrží pravděpodobně 1 pacient na 1 tis. obyvatel kumulativní efektivní dávku vyšší než 100 mSv za pět let. Při počtu 10,5 mil. obyvatel to znamená, že za oněch pět let máme v ČR přibližně 10,5 tis. pacientů s kumulativní efektivní dávkou vyšší než 100 mSv. Což není úplně málo. Další šokující zjištění na základě analýzy dat přišlo následně, když se zjistilo, že více než 1 tis. pacientů obdržel za jeden den kumulativní efektivní dávku vyšší než 100 mSv a 31 tis. pacientů obdrželo kumulativní efektivní dávku vyšší než 50 mSv za jeden den. To znamená, že tito pacienti podstoupili i několik CT vyšetření během jednoho dne (navíc zde nejsou zahrnuty ještě další radiodiagnostické, případně radioterapeutické výkony, např. intervenční výkony, u který pacienti také mohou v jednom sezení obdržet několik desítek mSv). Často se vůbec nejednalo o starší pacienty, 20 % pacientů bylo mladší než 50 let, tj. každý pátý pacient. Z hlediska indikací, a tedy onemocnění, se ukázalo, že 10 % pacientů bylo indikováno k CT vyšetření z důvodu nemaligního onemocnění.
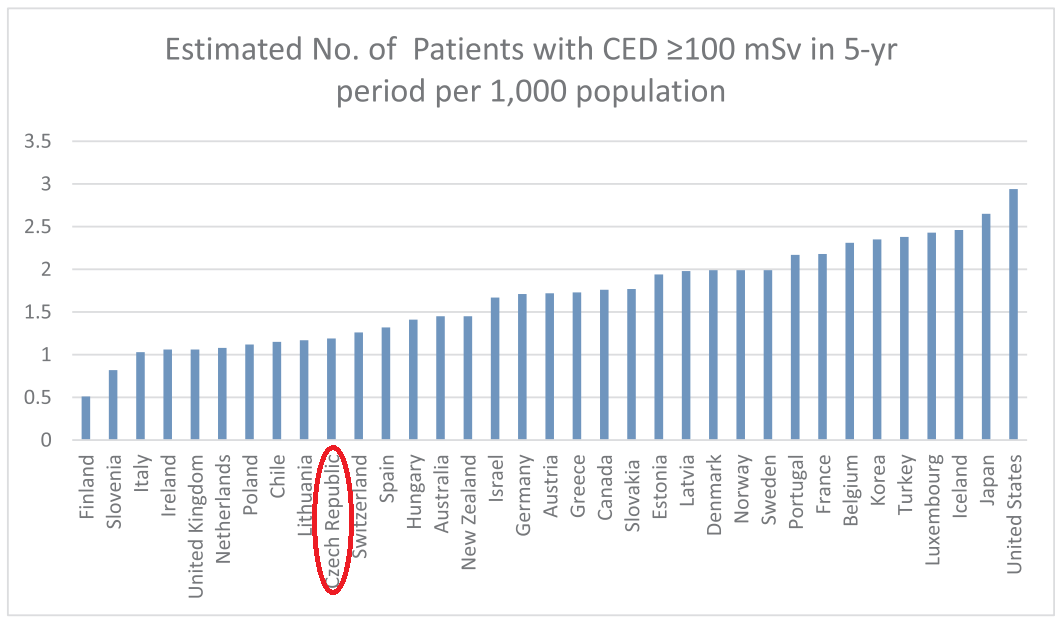 Obr. 1: Počet pacientů s kumulativní efektivní dávkou vyšší než 100 mSv za 5 let normovaný na 1000 obyvatel
Obr. 1: Počet pacientů s kumulativní efektivní dávkou vyšší než 100 mSv za 5 let normovaný na 1000 obyvatel
Použitá literatura
Rehani, M. Radiation doses in recurrent imaging: Where do we stand and way forward? Technical meeting on the justification and optimization of protection of patients requiring multiple imaging procedures. IAEA, October 19-23, 2020




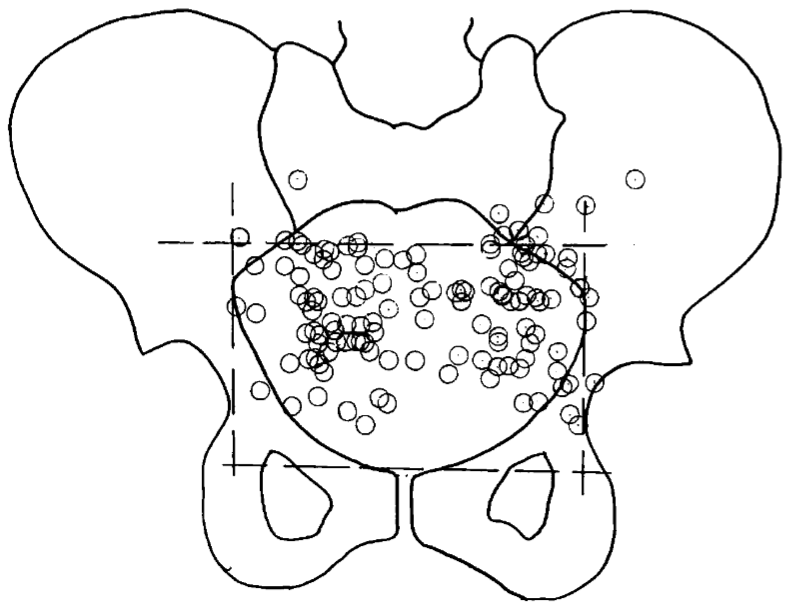 Obr. 1: Pozice vaječníků u 70 žen [2]
Obr. 1: Pozice vaječníků u 70 žen [2]
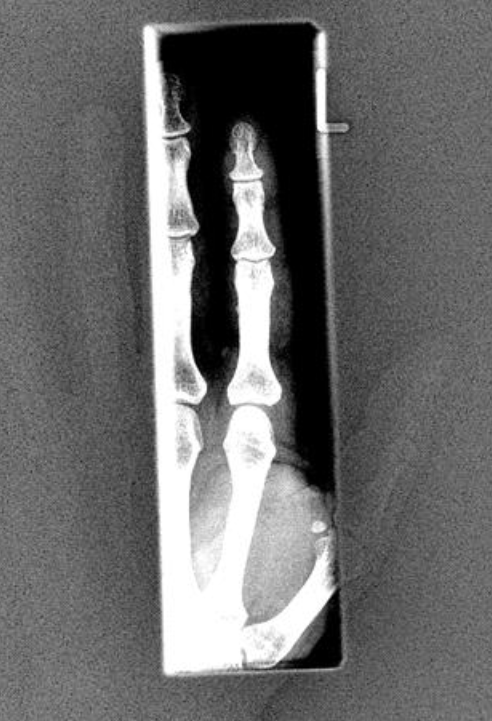 Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]
Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]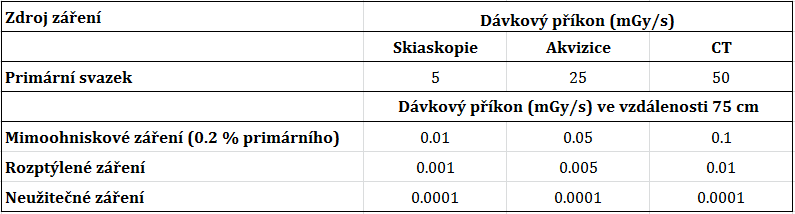 Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]
Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]