V předešlém příspěvku byl nastíněn přínos photon-counting detektorů (PCD), což je zejména odlišení rtg fotonů různých energií a jejich rozdělení do energetických binů pro lepší charakterizaci materiálu. Tento článek se zabývá prostorovým rozlišením PCD a samozřejmě i běžných energii-integrujících detektorů (EID).
Prostorové rozlišení
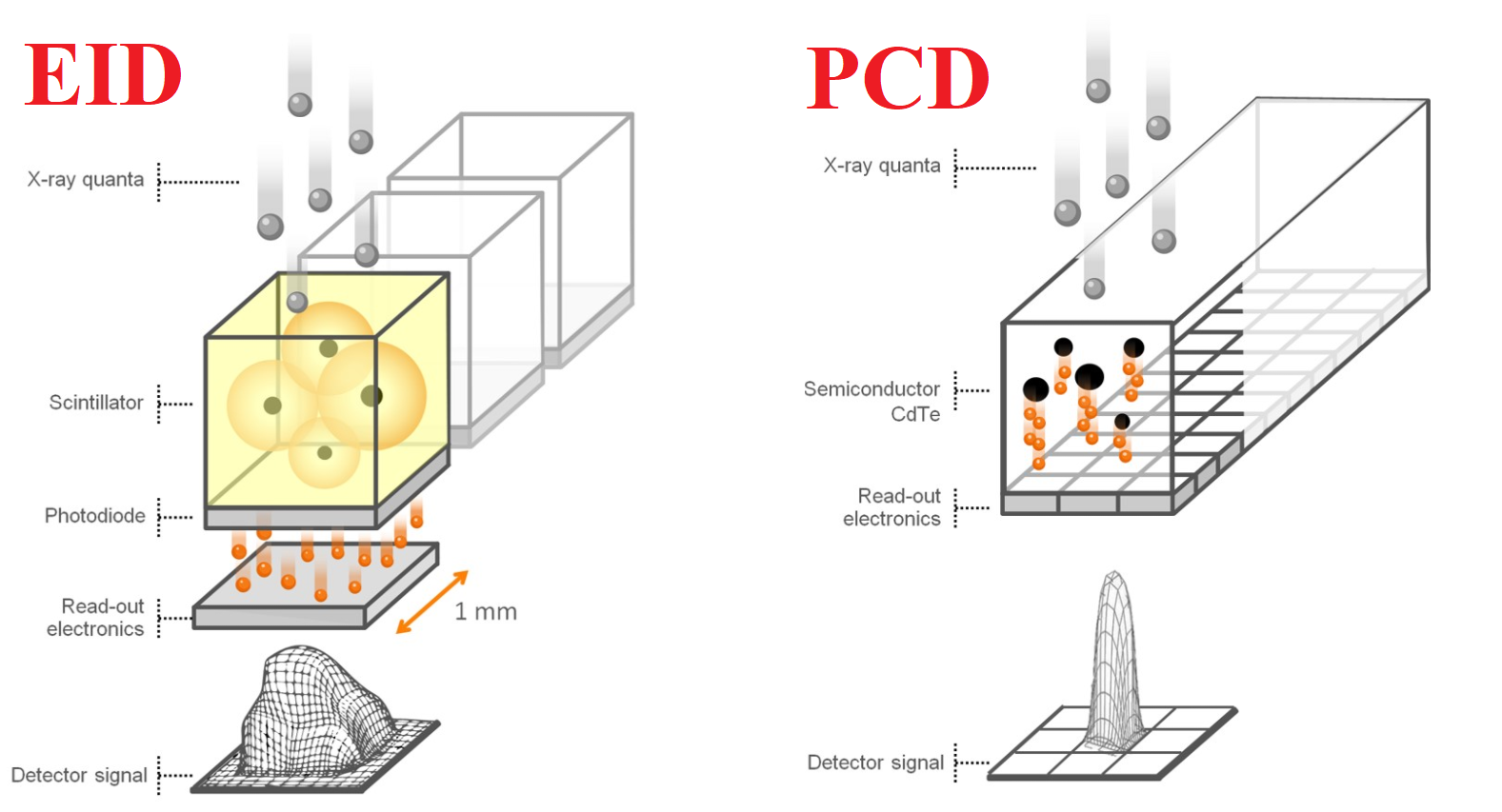
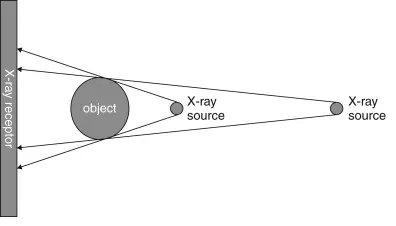
Mějme dva typy materiálu detektoru – polovodičový a scintilační. Nechť oba dva fungují v módu, kdy dokáží odlišit fotony různých energií, tedy v photon-counting módu (lze to i u scintilačních, ale kvůli nevýhodám se scintilační detektory v photon-counting módu na CT nepoužívají). Po dopadu rtg fotonu do materiálu detektoru dochází k interakci. Při interakci v materiálu detektoru by mělo dojít k absorpci fotonu přesně v místě interakce, ale bohužel dochází někdy také k rozptylu fotonu (viz obr. 1). Místo absorpce rozptýleného fotonu však již nesouvisí nesouvisí s místem interakce původního fotonu. V polovodičovém materiálu (obr. 2 vlevo) je signál zaznamenán v několika pixelech anody (známé pod označením charge-sharing neboli sdílení náboje). Pro scintilační materiál bude kvůli rozptylu scintilačních fotonů signál zaznamenán ještě ve více pixelech fotodiody (obr. 2 vpravo), což vede ke zhoršení prostorového rozlišení.

Obr. 1: Polovodičový materiál (vlevo) a scintilační materiál (vpravo) (převzato z [1])
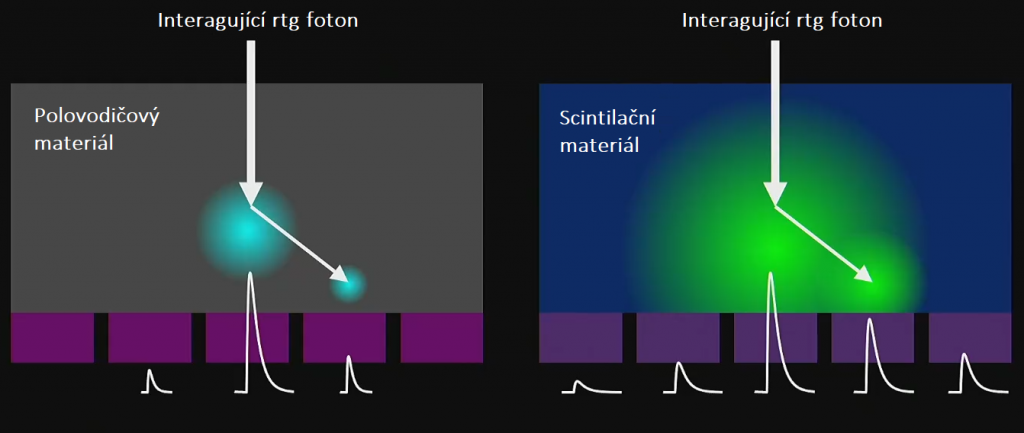
Obr. 2: Interakce rtg fotonu a vznik signálu v polovodičovém materiálu (vlevo) a ve scintilačním materiálu (vpravo) (převzato z [1])
Odstranění některých detekovaných signálů je možné u detektorů pracujících ve photon-counting módu prahováním neboli použitím určitého energetického prahu, viz obr. 3. To pak znamená, že pouze signály s hodnotou vyšší než je práh jsou použity pro další zpracování. Signály s nižší hodnotou jsou odfiltrovány a tedy nejsou dále použity. V praxi to znamená, že použitím prahování lze získat lepší prostorové rozlišení, což logicky vyplývá již z obr. 3. Bude-li však práh nastavený příliš vysoko, snižuje se tím pak citlivost detektoru, protože je použito pouze velmi málo fotonů pro další zpracování.
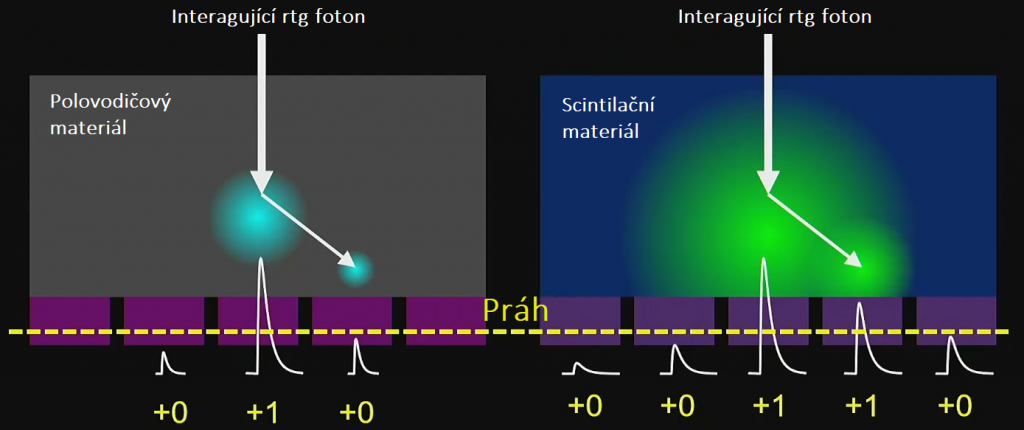
Obr. 3: Energetické prahování s filtrací některých signálů pro polovodičový a scintilační materiál (převzato z [1])
Časové rozlišení
Pro detekci jednotlivých rtg fotonů musí být detektor velmi rychlý, aby dokázal jednotlivé fotony mezi sebou odlišit. Např. u 2D angiografie je možné ve photon-counting módu s detektorem s velmi rychlou odezvou odlišit i tok a způsob toku kontrastní látky v cévách, což použitím energii-integrujícího módu nelze. Ukázka je uvedená na obr. 4 pro uměle vytvořené cévní aneuryzma (výduť).

Obr. 4: Odezva detektoru pracujícího v energii-integrujícím módu (vlevo) a ve photon-counting módu (vpravo) (převzato z [1] – horší kvalita obrazu, protože se jedná o záznam z videa)
Typy detektorů
Jak bylo zmíněno již dříve, platí, že jak scintilační (detektor s nepřímou konverzí), tak polovodičový (detektor s přímou konverzí) materiál lze použít ve photon-counting módu neboli módu čítajícím jednotlivé fotony. Logicky je tedy jasné, že i polovodičový detektor je možné použít v energii-integrujícím módu. Ale ne každý polovodičový detektor dokáže pracovat ve photon-counting módu. To, zda lze detektor použít ve photon-counting módu, je dáno rychlostí vyčítání a zpracování signálu detektorem.
Takže přímá a nepřímá konverze je dána materiálem detektoru, ale způsob vyhodnocení, tedy energii-integrující nebo photon-counting mód, je dán způsobem načítání a zpracování signálu.
Grafické znázornění rozdělení detektorů je uvedeno na obr. 5. Photon-counting detektor samozřejmě může být i plynový. Polovodičové PCD používané na některých CT využívají vlastností jak polovodičových detektorů (lepší prostorové rozlišení, vysoká konverzní účinnost), tak také photon-counting detektorů (odstranění šumu, spektrální informace).
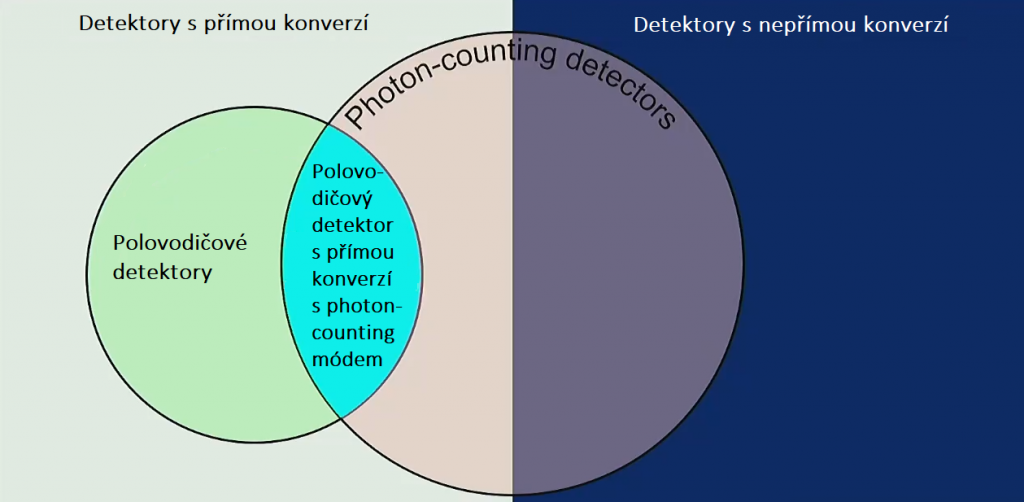
Obr. 5: Rozdělení materiálů detektorů (převzato z [1])
Přestože scintilační i plynový detektor mohou pracovat ve photon-counting módu, nejsou u tzv. spektrálních CT využívány. Proč tomu tak je, bude objasněno v dalším příspěvku.
Použitá literatura
[1] Li K. Basic principles of photon-counting CT. Annual Meeting of Radiological Society of North America. 29. 11. 2023, Chicago


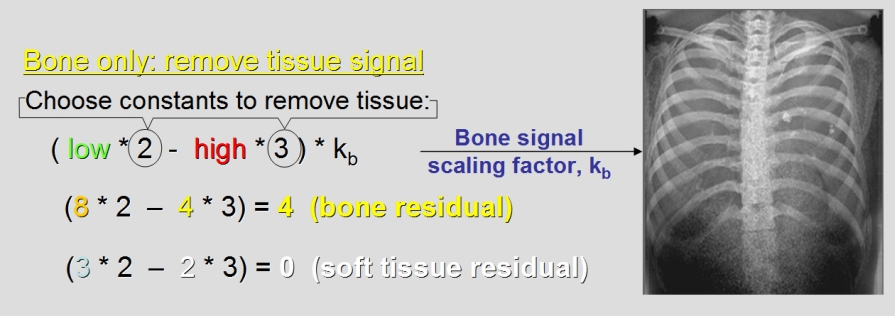
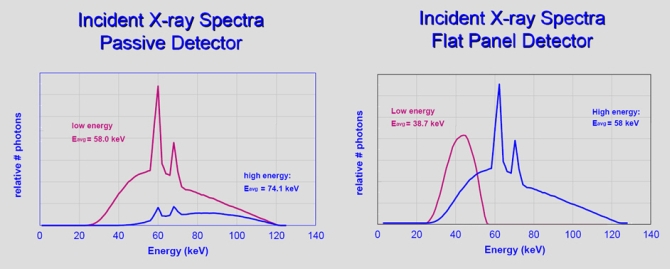
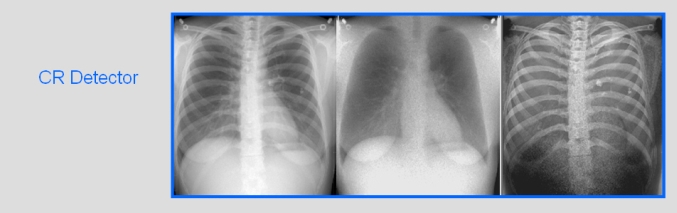
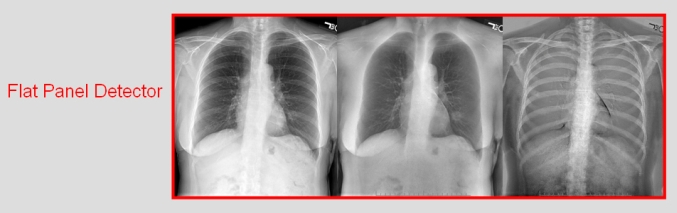


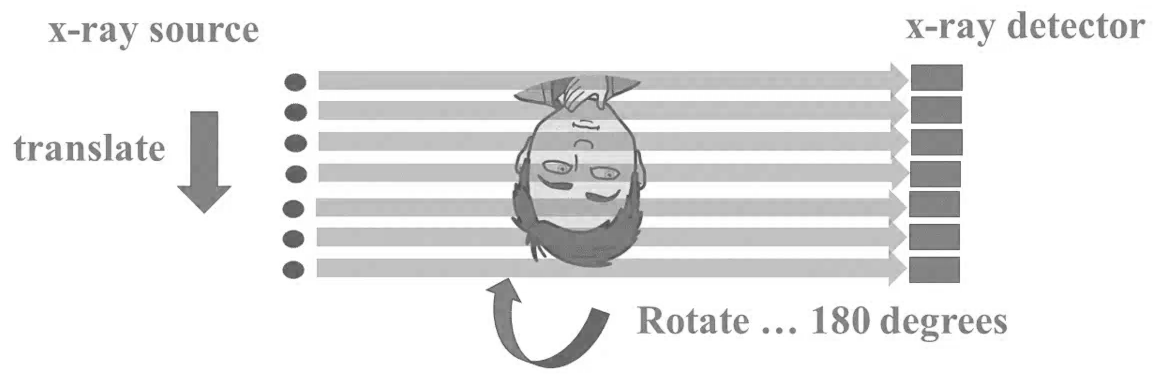

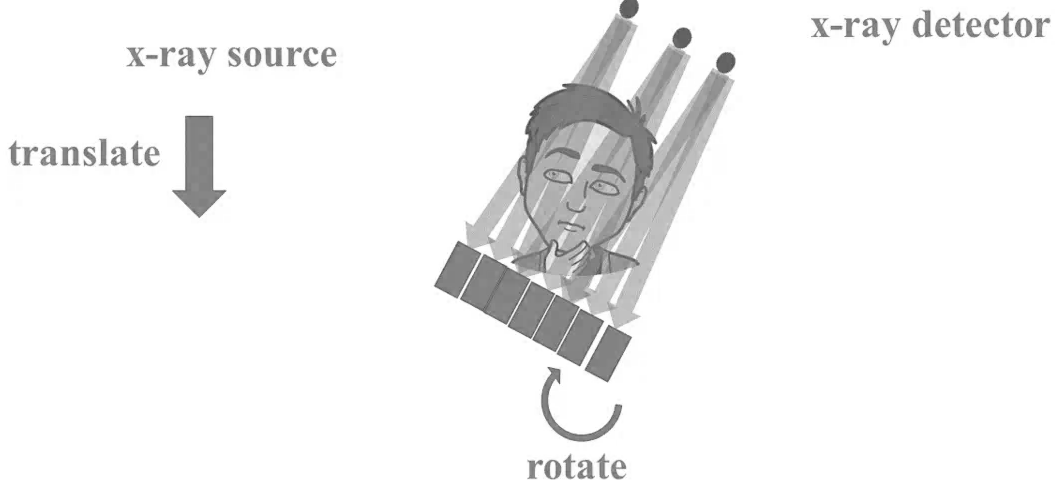

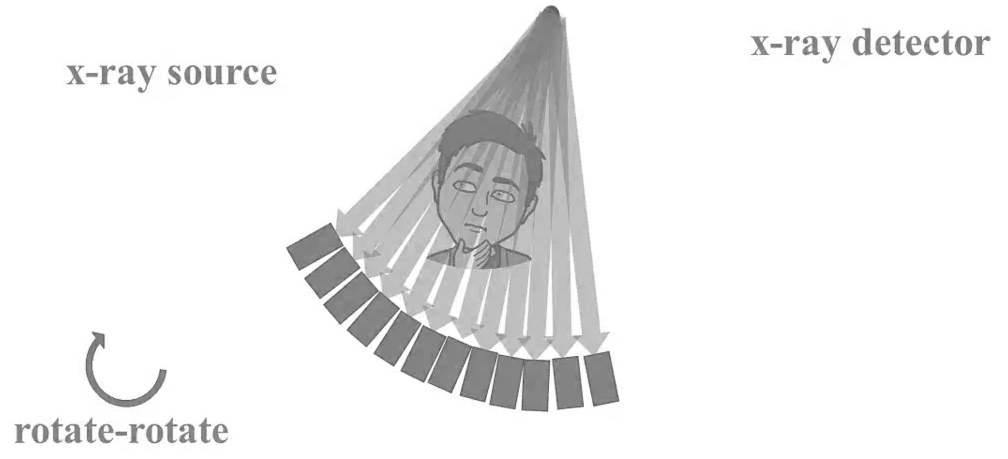




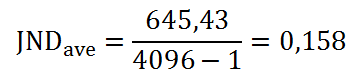
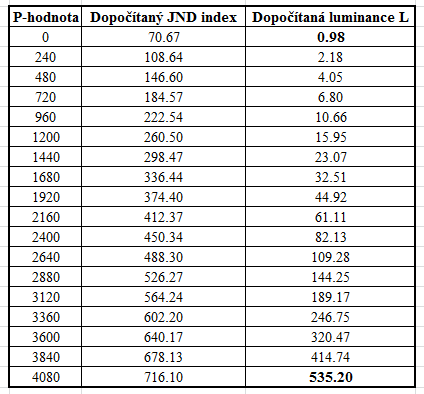
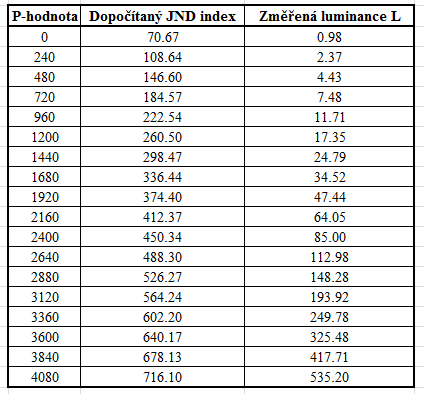
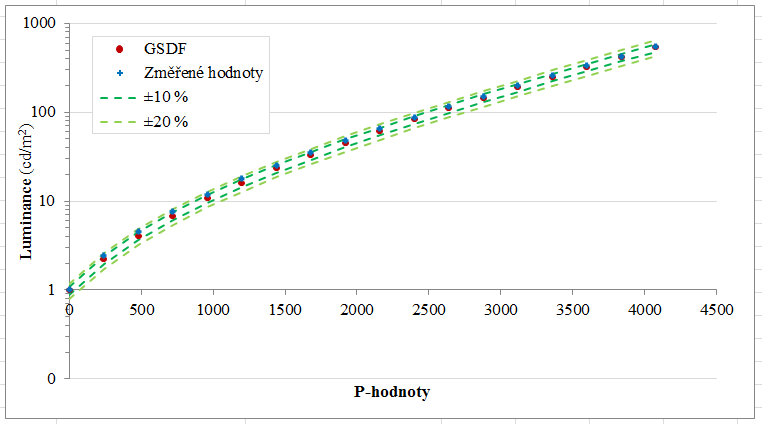
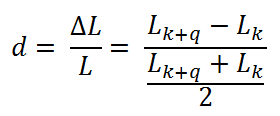
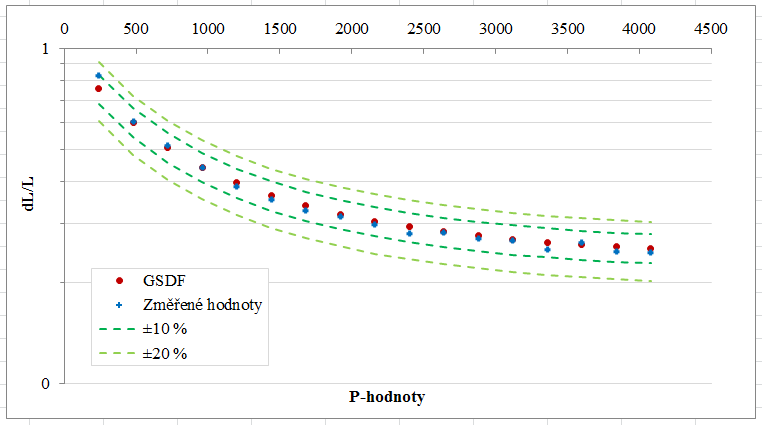
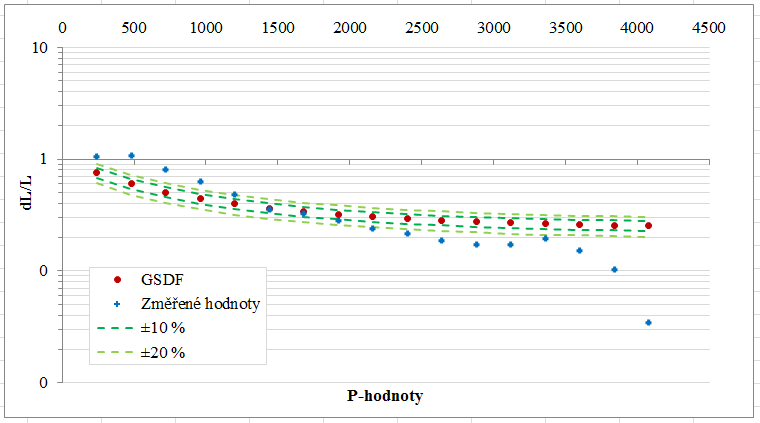
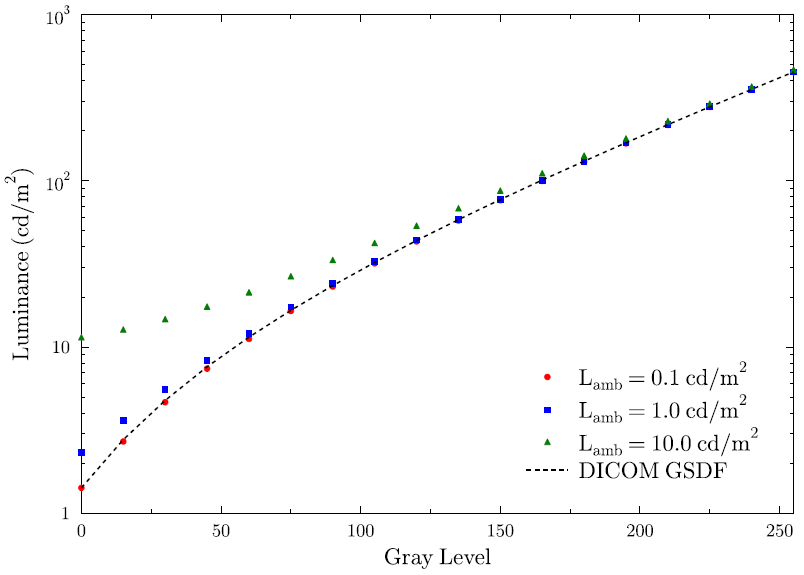
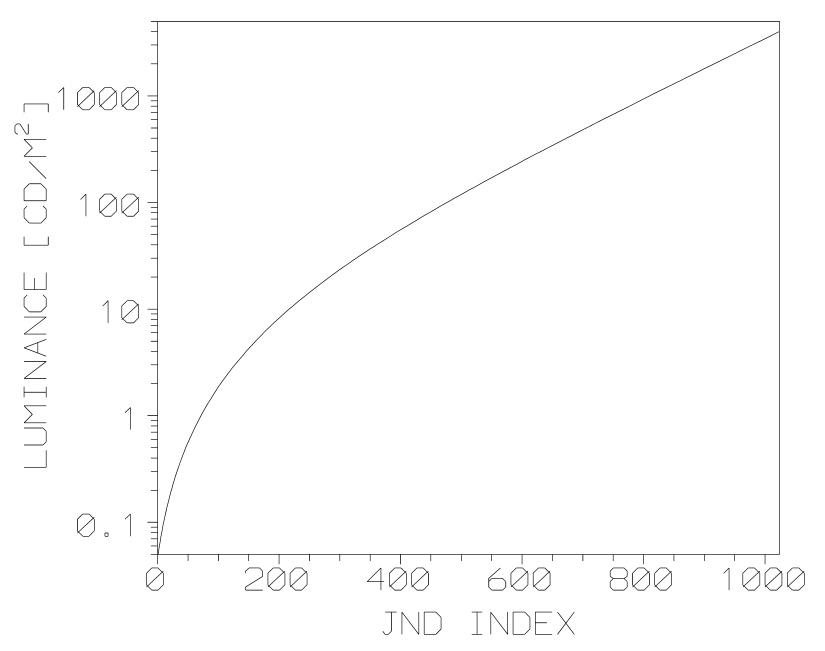
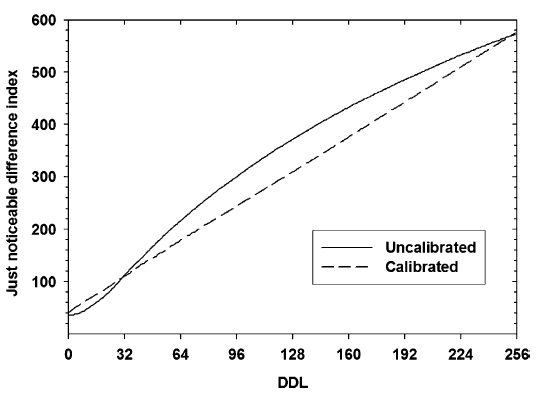
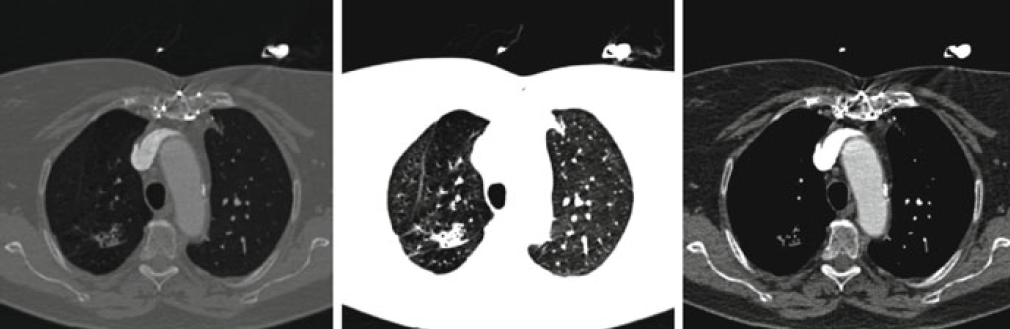
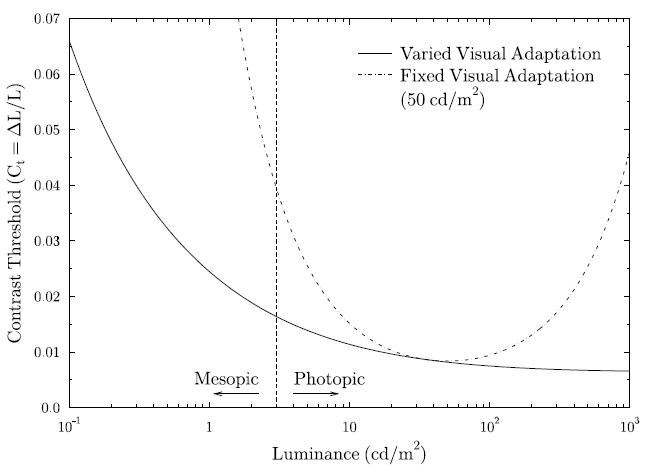
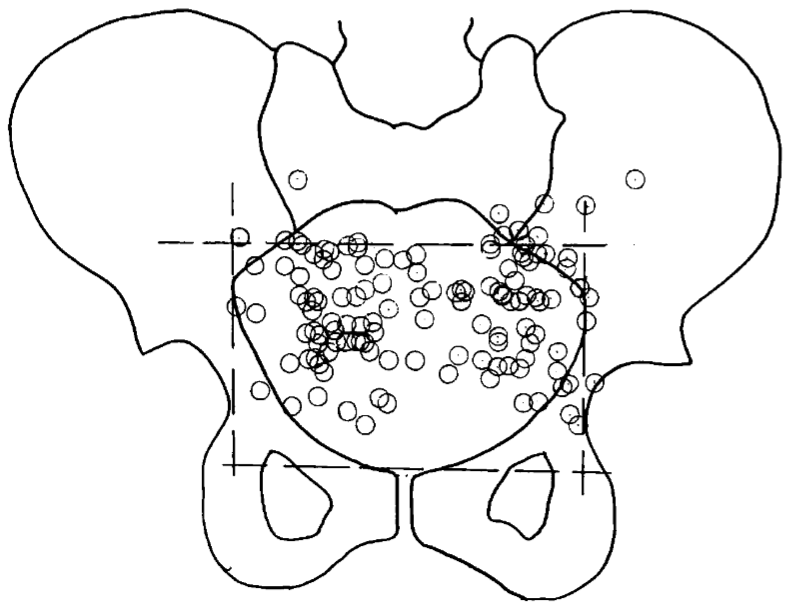 Obr. 1: Pozice vaječníků u 70 žen [2]
Obr. 1: Pozice vaječníků u 70 žen [2]
 Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]
Obr. 1: Příspěvek z mimoohniskového záření – šedá oblast okolo vykolimované oblasti [1]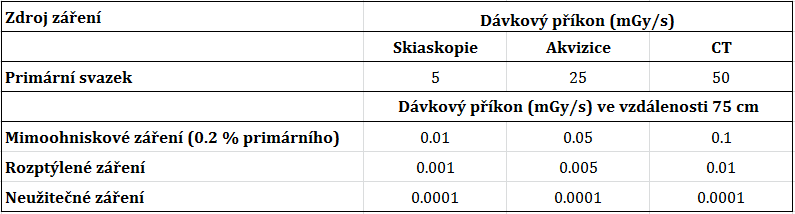 Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]
Tab. 1: Přehled dávkových příkonů primárního a sekundárního záření [1]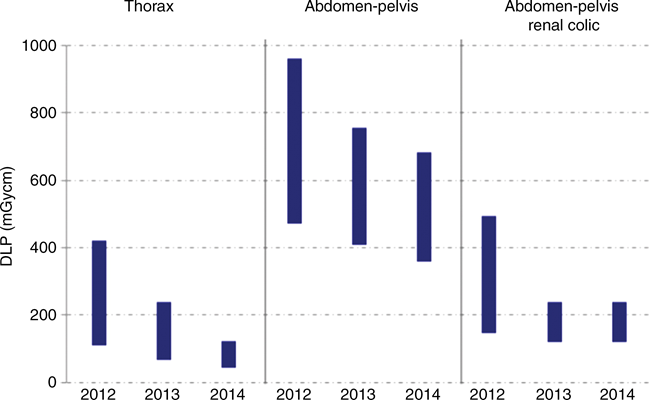 Obr. 1: Porovnání DLP hodnot v čase pro různé vyšetřovací protokoly
Obr. 1: Porovnání DLP hodnot v čase pro různé vyšetřovací protokoly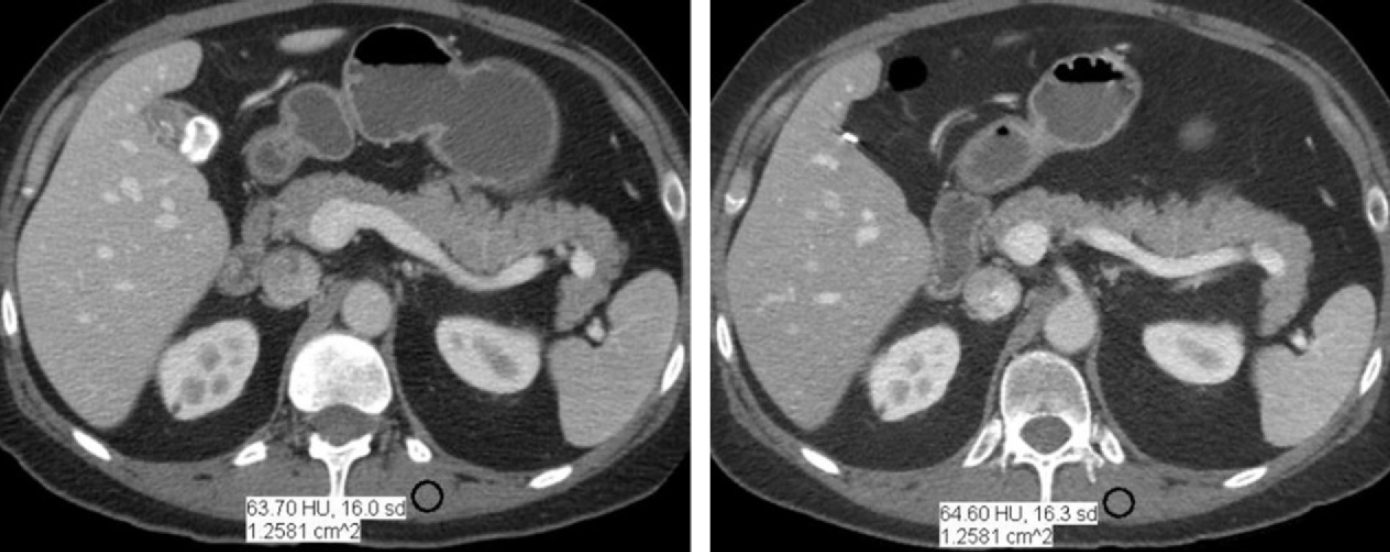 Obr. 1: CT obrazy rekonstruované filtrovanou zpětnou projekcí (nahoře vlevo) a ASIR rekonstrukcí se sílou 30 % (nahoře vpravo), 70 % (dole vlevo) a 100 % (dole vpravo) [1]
Obr. 1: CT obrazy rekonstruované filtrovanou zpětnou projekcí (nahoře vlevo) a ASIR rekonstrukcí se sílou 30 % (nahoře vpravo), 70 % (dole vlevo) a 100 % (dole vpravo) [1]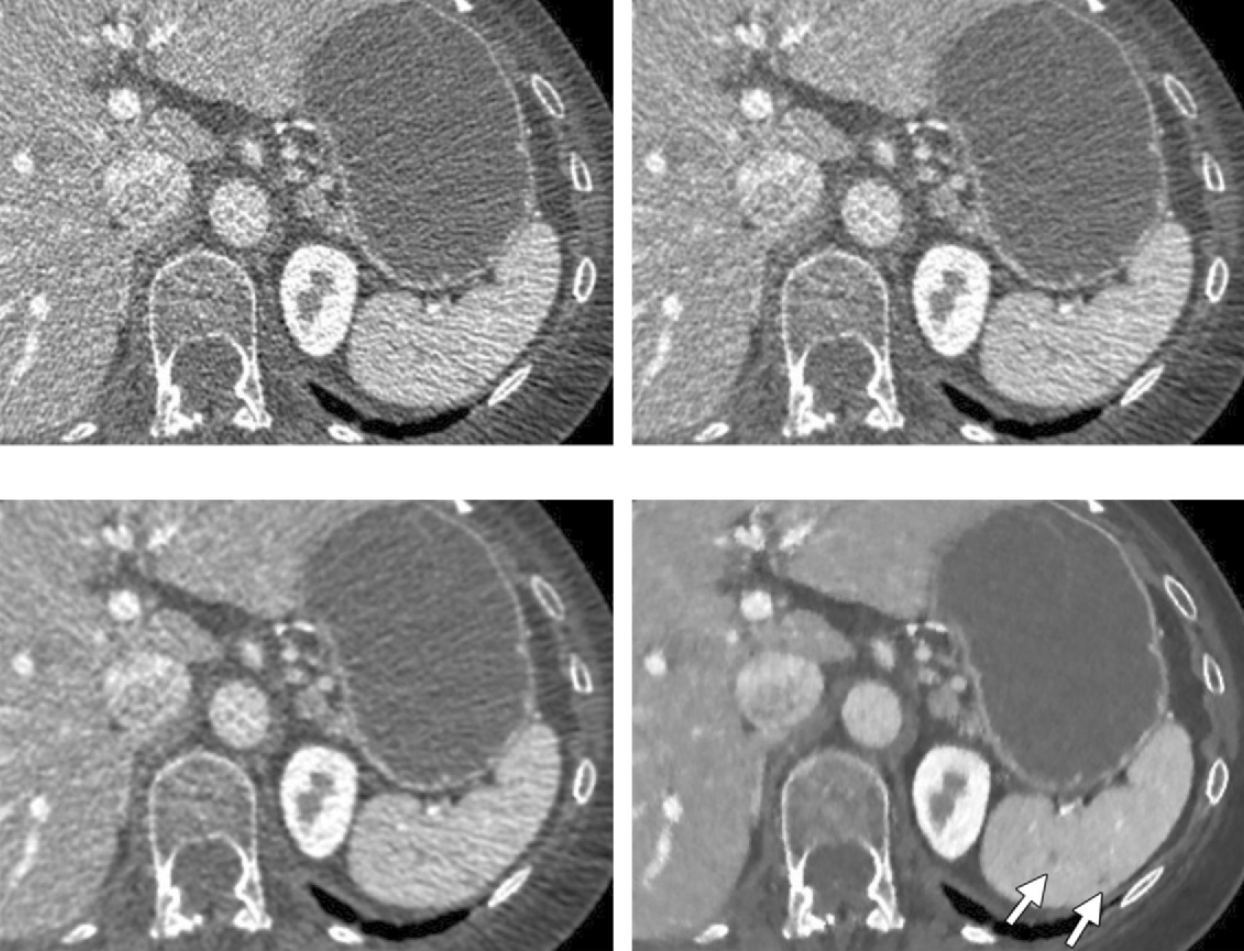 Obr. 3: CT obraz rekonstruovaný filtrovanou zpětnou projekcí (nahoře vlevo), ASIR rekonstrukcí se sílou 50 % (nahoře vpravo), ASIR rekonstrukcí se sílou 100 % (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]
Obr. 3: CT obraz rekonstruovaný filtrovanou zpětnou projekcí (nahoře vlevo), ASIR rekonstrukcí se sílou 50 % (nahoře vpravo), ASIR rekonstrukcí se sílou 100 % (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]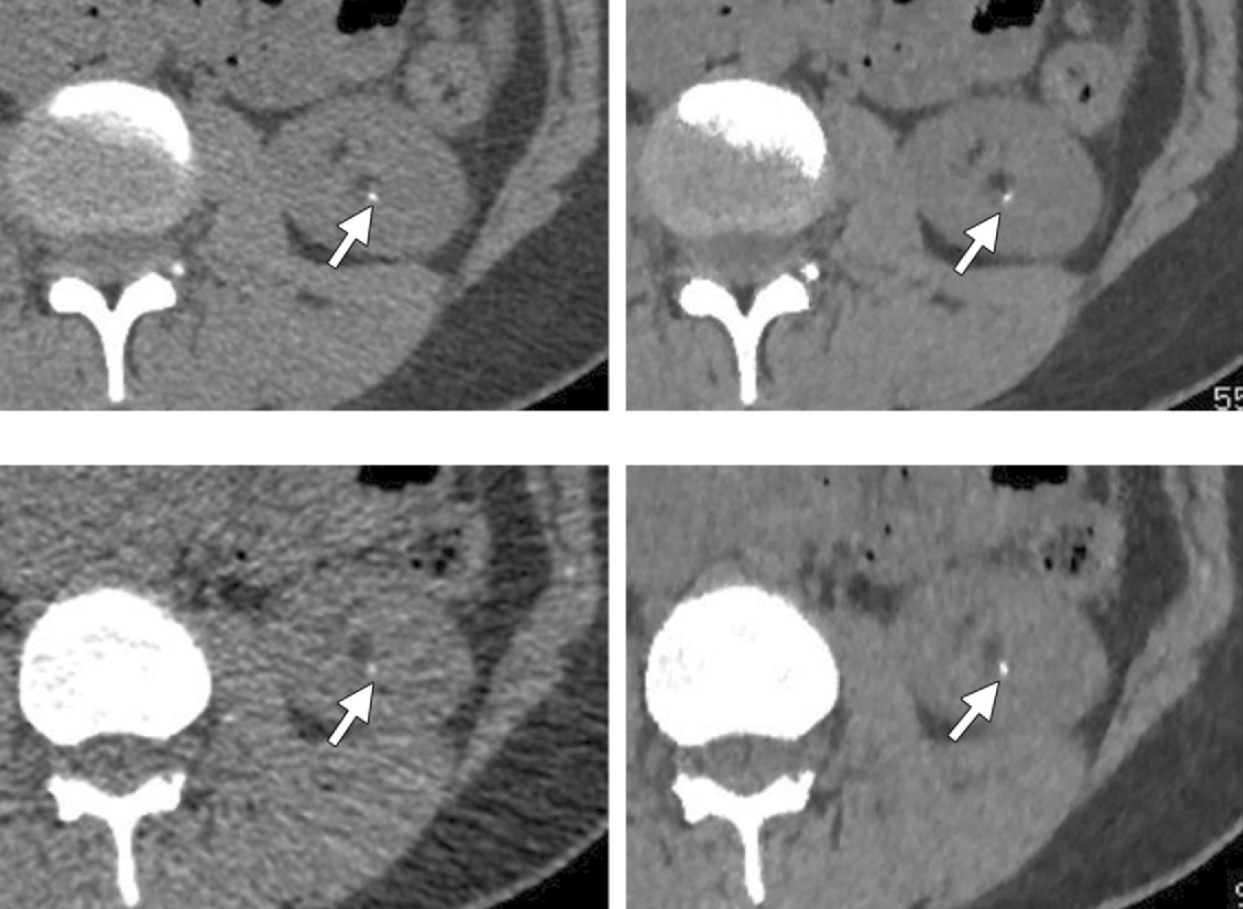 Obr. 4: CT obrazy pořízené s CTDI_vol = 3,57 mGy a zrekonstruované ASIR rekonstrukcí (nahoře vlevo) a MBIR rekonstrukcí (nahoře vpravo) a obrazy pořízené s dávkou CTDI_vol = 0,9 mGy zrekonstruované ASIR rekonstrukcí (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]
Obr. 4: CT obrazy pořízené s CTDI_vol = 3,57 mGy a zrekonstruované ASIR rekonstrukcí (nahoře vlevo) a MBIR rekonstrukcí (nahoře vpravo) a obrazy pořízené s dávkou CTDI_vol = 0,9 mGy zrekonstruované ASIR rekonstrukcí (dole vlevo) a MBIR rekonstrukcí (dole vpravo) [1]