Mějme objem určité látky V o hmotnosti m, se kterou interagují nenabité částice, pro rtg diagnostiku typicky rtg fotony. Část energie rtg fotonů ɛ_tr je vynaložena při různých interakcích na vznik sekundárních částic. Tato energie ɛ_tr je dána jako suma všech počátečních kinetických energií nabitých částic uvolněných nenabitými v daném objemu V. Nenabitými částicemi jsou pro energie v rtg diagnostice rtg fotony, nabitými částicemi elektrony, které vznikají např. při fotoefektu nebo při nekoherentním rozptylu (Comptonův rozptyl). Proto vynaložená energie ɛ_tr odpovídá sumě počátečních kinetických energií elektronů v okamžiku jejich vzniku.
Jakmile reagují nabité částice (elektrony) s látkou, část jejich kinetické energie může být vyzářena ve formě brzdného záření. Avšak v rozsahu energií v rtg diagnostice je tato interakce velmi nepravděpodobná, tedy zanedbatelná.
Nyní máme energii ɛ_tr vynaloženou na vznik sekundárních částic v látce o objemu V a hmotnosti m. Nechť je R_in energie záření, která do objemu V vstupuje, a R_out energie, která z objemu V vystupuje. Pak sdělená energii ɛ danému objemu látky V je rovna rozdílu energií R_in a R_out, ɛ = R_in-R_out.
Na základě výše definovaných veličin již můžeme definovat kermu (akronym Kinetic Energy Released per unit MAss): K = dɛ_tr/dm neboli kerma je rovna podílu součtu počátečních kinetických energií všech nabitých částic uvolněných nenabitými v malém objemu látky dV o hmotnosti dm. Jednotkou je J/kg a nazývá se Gray, značka Gy.
Pro kermu platí, že může být definována v jakémkoli materiálu, proto je nutné uvést, ke kterému materiálu se kerma vztahuje. Kerma je definována pouze pro nenabité (nepřímo ionizující) částice, tj. fotony a neutrony. Kerma popisuje první krok při interakci nenabitých částic s látkou – předání energie z nenabitých částic na nabité částice. Neméně důležitý předpoklad pro definici kermy je ten, že energie sekundárně vzniklých částic (elektronů v rtg diagnostice) nemusí zůstat v malém objemu dV, ve kterém částice vznikly, kerma pracuje pouze s počáteční kinetickou energií těchto vzniklých částic. Kinetická energie elektronů je pak využita na excitaci a ionizaci atomů látky, ve které elektrony interagují.
Absorbovaná dávka je rovna podílu sdělené energie dɛ dodané látce o hmotnosti dm a této hmotnosti dm. D = dɛ/dm. Jednotkou je opět Gray (J/kg), značka Gy. Absorbovaná dávka popisuje druhý krok interakce nenabitých částic s látkou, jde o popis depozice energie nabitých částic v látce.
Jak je vidět již z definic obou veličin, jsou mezi nimi rozdíly. Jedním z rozdílů je objem látky, ke kterému se veličiny vztahují. Kerma pracuje s objemem, ve kterém došlo ke vzniku částic, tedy objemem, kde byla předána energie z nenabitých částic nabitým. Dávka pracuje s objemem, ve kterém se deponovala kinetická energie těch vzniklých nabitých částic.
Největší rozdíl mezi veličinami je však na rozhraní dvou materiálů, kde jsou rozdílné hustoty ionizace a rozdílný rozptyl. Na rozhraní dvou materiálů je změna v hodnotě kermy skoková, je daná podílem hmotnostních součinitelů přenosu energie obou materiálů, zatímco dávka se mění postupně až do hloubky, která odpovídá dosahu sekundárních částic (elektronů v rtg diagnostice).
Podíl hmotnostních součinitelů přenosu energie na rozhraní kosti a měkké tkáně je graficky znázorněn na obr. 1.
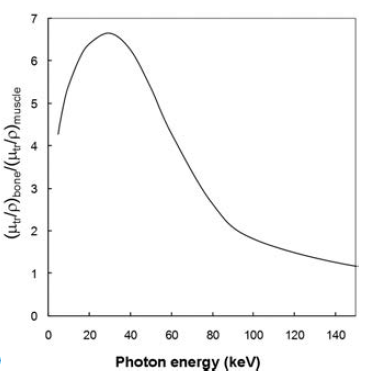 Obr. 1: Podíl hmotnostních součinitelů přenosu energie na rozhraní kosti a měkké tkáně pro různé energie [1]
Obr. 1: Podíl hmotnostních součinitelů přenosu energie na rozhraní kosti a měkké tkáně pro různé energie [1]
Z obr. 1 je zřejmé, že změny kermy pro rtg fotony v rozsahu energií používaných v rtg diagnostice jsou na rozhraní kosti a měkké tkáně velmi významné. Současně však také v závislosti na dosahu sekundárních elektronů (konkrétní hodnoty dosahu sekundárních elektronů jsou uvedeny v tab. 1) vznikajících v důsledku interakcí rtg fotonů lze říct, že absorbovaná dávka je tím ovlivněna pouze do velmi malé hloubky (odpovídající dosahu sekundárních elektronů), do hloubky menší než cca 1 mm.
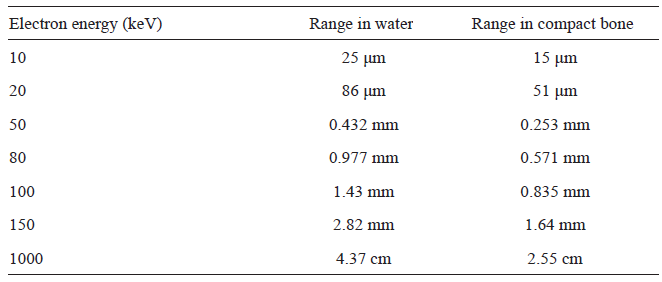 Tab. 1: Dosahy sekundárních elektronů ve vodě a v kosti [1]
Tab. 1: Dosahy sekundárních elektronů ve vodě a v kosti [1]
Obecně zjednodušeno platí, že pro energie fotonů používaných v rtg diagnostice se předpokládá, že v materiálech s nízkým Z (měkké tkáně i kosti) jsou si kerma a dávka rovny (od určité hloubky v ozařovaném objemu, kdy je dosaženo elektronové rovnováhy, tato hloubka odpovídá dosahu sekundárních elektronů, tj. od hloubky větší než cca 1 mm, tedy prakticky skoro vždy; podíl energie vynaložené na vznik brzdného záření je zanedbatelný, k této interakci při rtg energiích nedochází). U vyšších energií to však předpokládat nelze.
Použitá literatura
[1] Dance DR, Christofides S, Maidment ADA, McLean ID, Ng KH. Diagnostic radiology physics: A handbook for teachers and students. International Atomic Energy Agency, 2014

 Obr. 1: Rekonstrukce filtrovanou zpětnou projekcí (vlevo) a iterativní rekonstrukcí SAFIRE se sílou 1, 3 a 5 (síla 5 na obr. úplně vpravo)
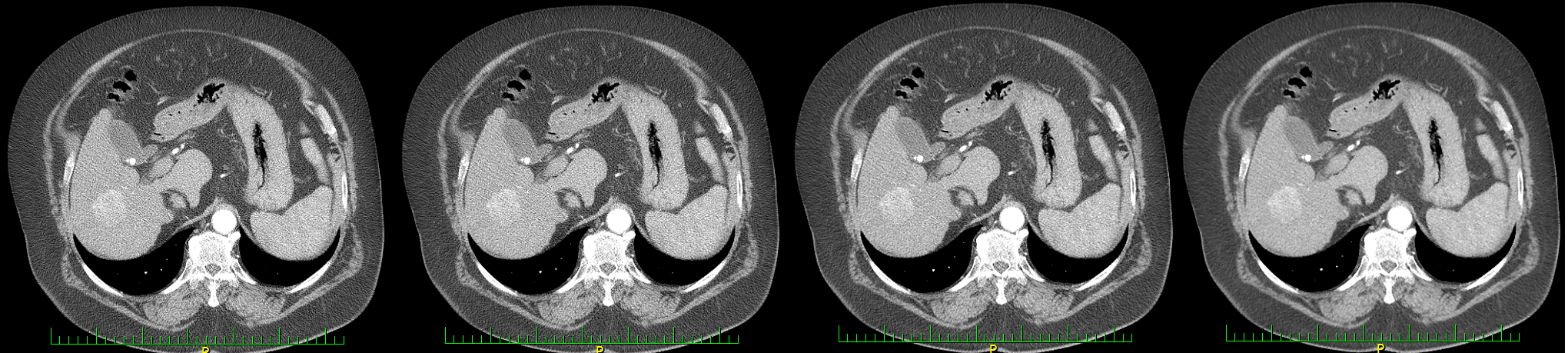
Obr. 1: Rekonstrukce filtrovanou zpětnou projekcí (vlevo) a iterativní rekonstrukcí SAFIRE se sílou 1, 3 a 5 (síla 5 na obr. úplně vpravo)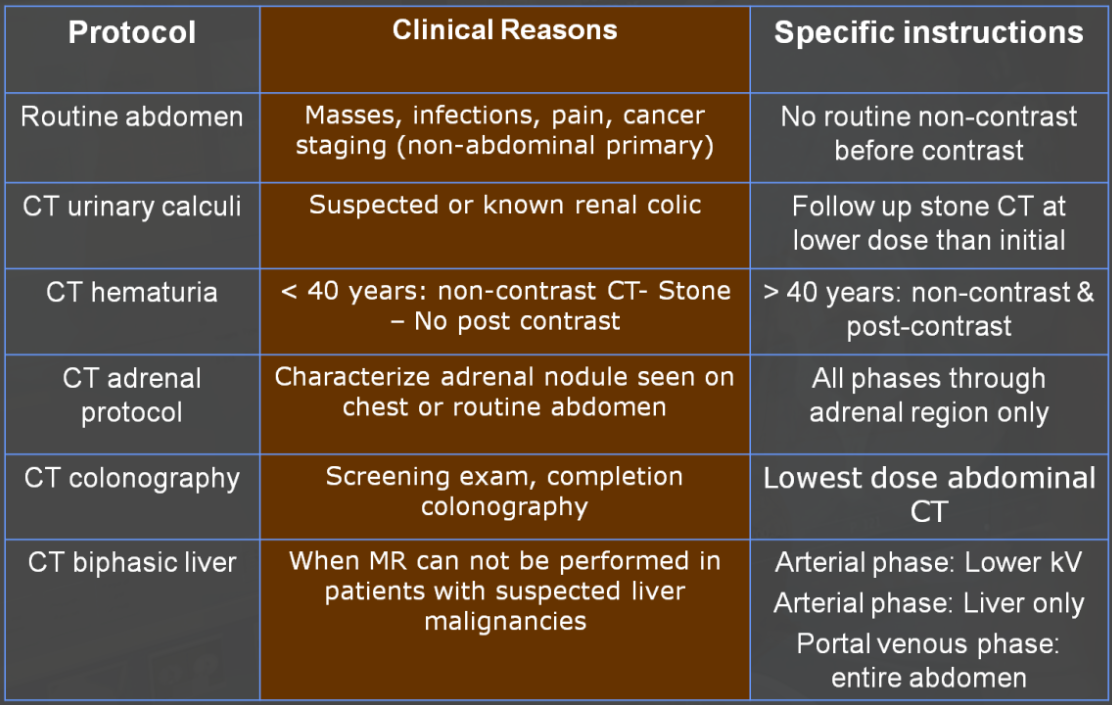 Obr. 2: Ukázka CT protokolů břicha
Obr. 2: Ukázka CT protokolů břicha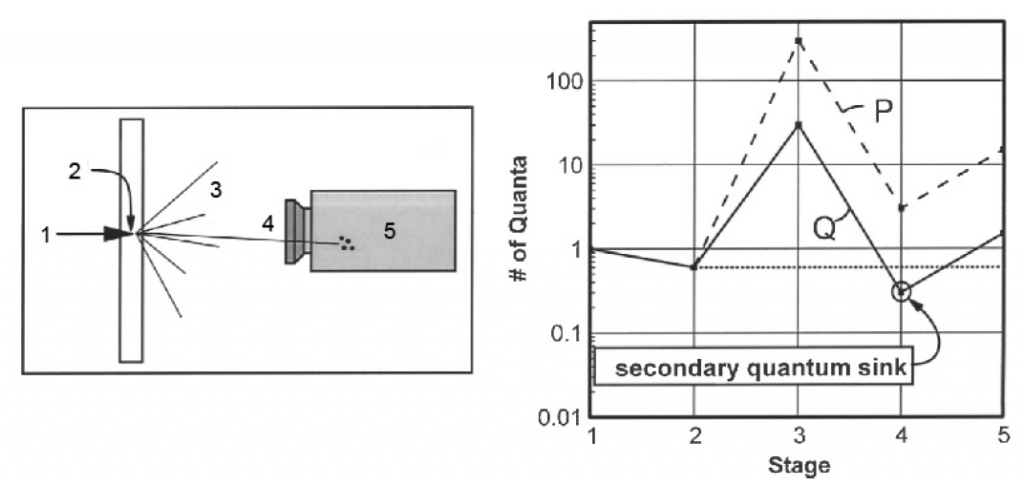 Obr. 1: Kroky při detekci záření (vlevo) a množství vznikajících kvant (vpravo)
Obr. 1: Kroky při detekci záření (vlevo) a množství vznikajících kvant (vpravo)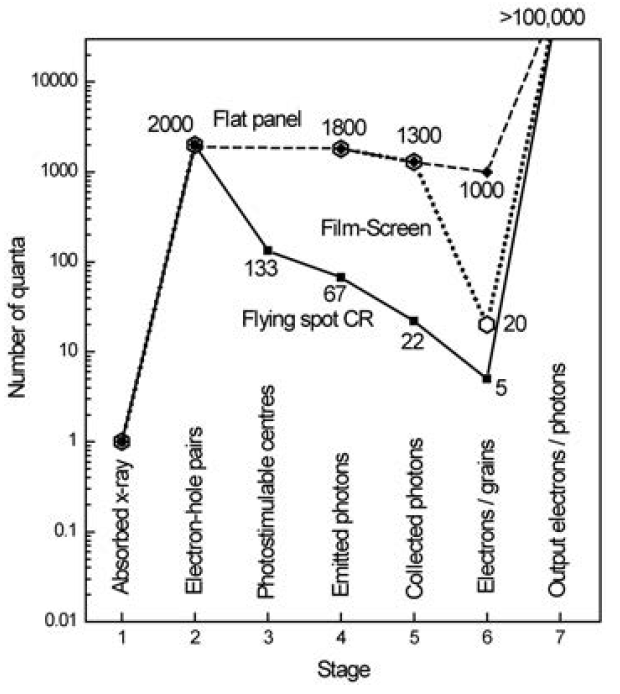
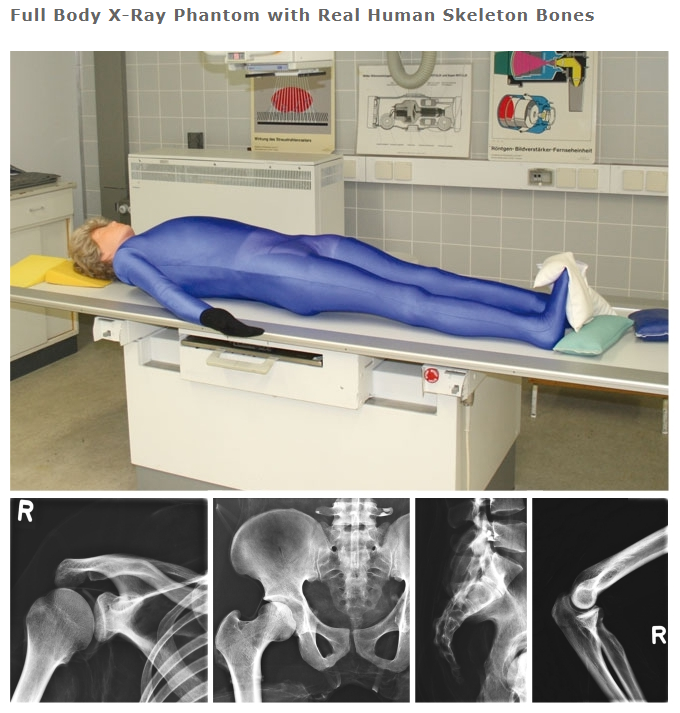
 Obr. 1: Ukázka adaptivního stínění (Siemens)
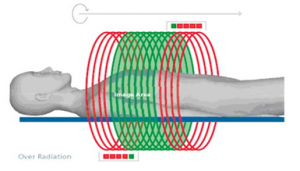
Obr. 1: Ukázka adaptivního stínění (Siemens)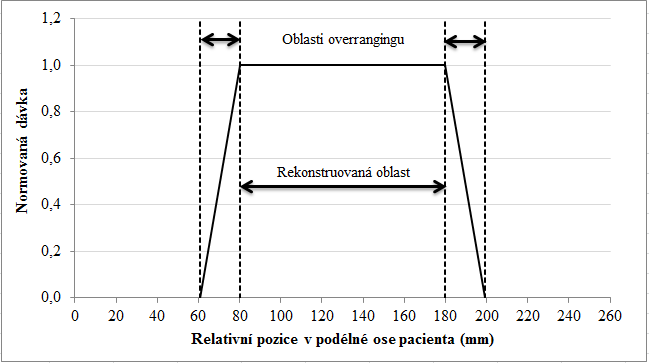 Obr. 1: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 38,4 mm
Obr. 1: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 38,4 mm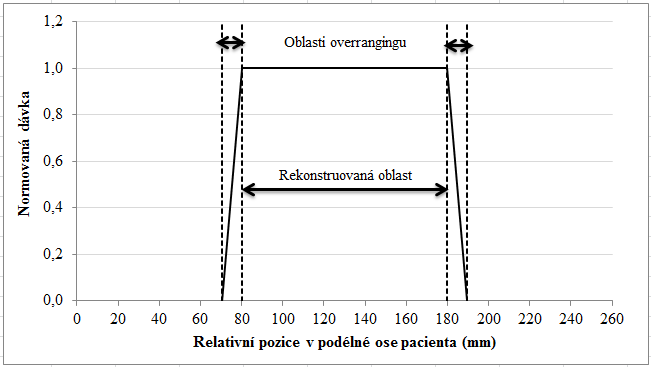 Obr. 2: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 19,2 mm
Obr. 2: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 19,2 mm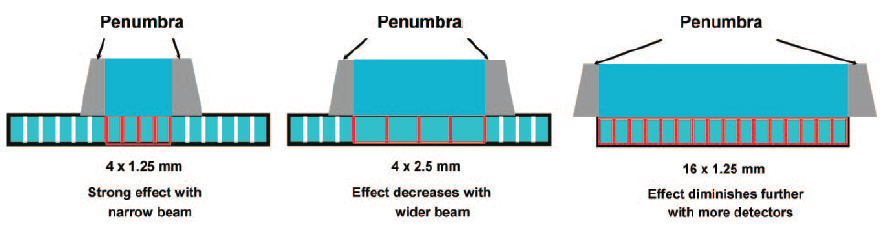 Obr. 3: Ukázka overbeamingu (šedou barvou) u různých skenů
Obr. 3: Ukázka overbeamingu (šedou barvou) u různých skenů
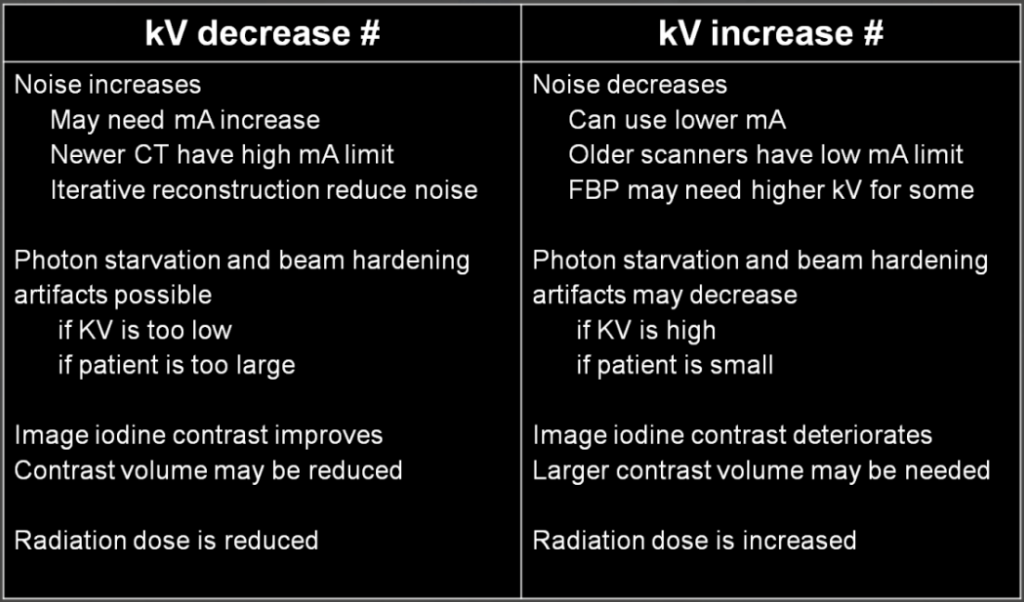 Obr. 1: Změny vyvolané použitím nižšího a vyššího napětí
Obr. 1: Změny vyvolané použitím nižšího a vyššího napětí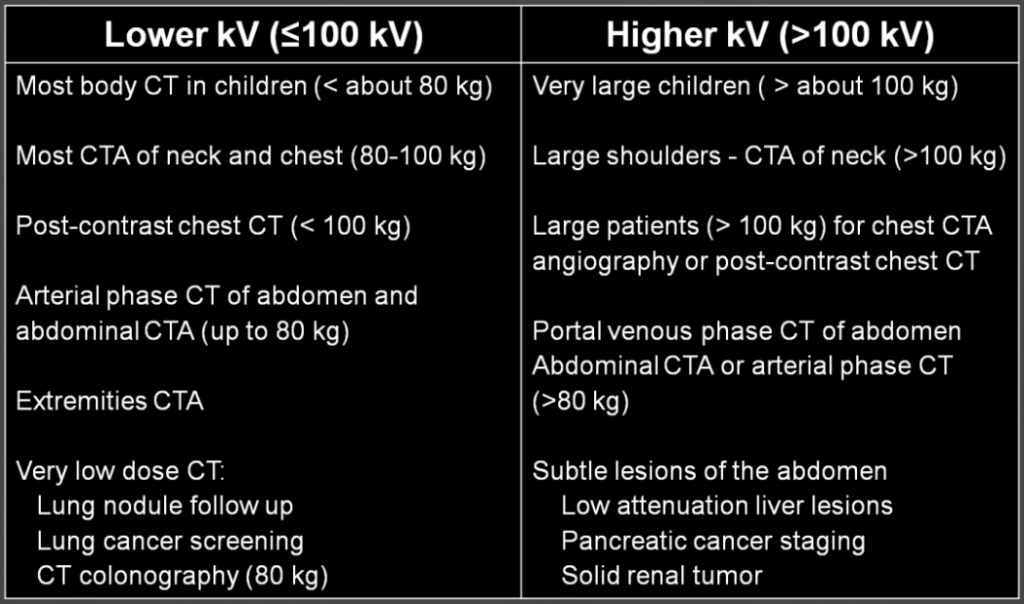 Obr. 2: Doporučení pro napětí 100 kV a méně a pro více než 100 kV
Obr. 2: Doporučení pro napětí 100 kV a méně a pro více než 100 kV