Převzato z časopisu Praktická radiologie 2018; 1:04-06
Expoziční automatika (Automatic Exposure Control, AEC) je nástroj, který ukončuje rtg expozici tehdy, dopadne-li na receptor obrazu dostatečné množství záření. Primárním cílem AEC je přispět k získání radiografického obrazu dostatečné kvality pro pacienty různých anatomických rozměrů a patologií s použitím přednastavených expozičních parametrů (napětí kV, proud mA, velikost ohniska, proti-rozptylová mřížka) a dané geometrie (velikost pole, vzdálenost ohnisko-receptor obrazu) tím, že ovlivní dobu expozice, a tedy i dávku, kterou pacient obdrží. Rtg obrazy produkované na rtg systému s použitím AEC jsou vzhledově velmi konzistentní, tedy i lépe hodnotitelné pro lékaře. Hlavní výhodou AEC je redukce opakovaných vyšetření z důvodu špatně nastavených expozičních parametrů. Správné použití AEC zajišťuje uplatnění principu ALARA v praxi, tedy získání dostatečné kvality obrazu (diagnostické výtěžnosti) za rozumných dávek. Když je radiologickým asistentům (RA) zřejmé, jak AEC funguje, jak ji lze ovlivnit a jaké jsou její limitace, stává se užitečným nástrojem umožňujícím produkovat rtg obrazy velmi dobré kvality.
Každá AEC je tvořena aktivními senzory, které kontrolují dávku, kterou AEC obdrží, a tím i dávku na receptoru obrazu. Standardní skiagrafické systémy disponují AEC se třemi senzory (pravý, levý a centrální), které jsou rozmístěny tak, jak je vidět na obr. 1. Při použití AEC je nutné, aby RA zvolil aktivní sensor nebo kombinaci aktivních senzorů (často přednastaveno v rámci orgánové předvolby), kterými bude kontrolována výsledná dávka na receptoru obrazu, kterým může být jak systém film-fólie, tak i nepřímá digitalizace CR, nebo flat panel detektor.
 Obr. 1: Tři senzory AEC (malé obdélníčky v prostřední části pole, https://radiologykey.com/automatic-exposure-control/)
Obr. 1: Tři senzory AEC (malé obdélníčky v prostřední části pole, https://radiologykey.com/automatic-exposure-control/)
Všechny AEC fungují na stejném principu. Rtg záření projde pacientem a interaguje se senzorem (senzory) AEC. Senzory AEC jsou nejčastěji tvořeny ionizačními komorami nebo polovodičovými detektory. Jakmile je v senzoru generován dostatečný elektrický signál, neboli senzor je ozářen dostatečnou dávkou, dojde k ukončení expozice. Ionizační komory se nacházejí mezi pacientem a receptorem obrazu, proto rtg záření interaguje nejprve s AEC, poté teprve s receptorem obrazu. Plocha receptoru obrazu „zastíněná“ senzory AEC je velmi malá, navíc obraz není přítomností senzorů nijak ovlivněn, jsou-li použity rtg fotony určité energie (objasněno dále v textu). U rtg systémů s polovodičovými detektory je to naopak, rtg záření nejprve interaguje v receptoru obrazu, teprve poté s AEC. Je to z toho důvodu, že senzory tvořené polovodičovými detektory by byly v obraze viditelné. AEC systémy s ionizačními komorami jsou méně přesné v regulaci expozice, ale současně jsou méně náchylné k poruchám. Většina současných rtg systémů využívá AEC se senzory tvořenými ionizačními komorami. Tyto senzory jsou tedy standardně umístěny těsně před receptorem obrazu, pouze mamografie a některé pediatrické rtg systémy jsou výjimkou, neboť by mohlo dojít k tomu, že kvůli nízké energii záření budou senzory v obraze viditelné. To je však nežádoucí artefakt, proto opačné uspořádání AEC a receptoru obrazu. U moderních rtg systémů je AEC již součástí samotných flat panel detektorů. V případě, že rtg systém využívá protirozptylové mřížky, pak je AEC vždy umístěna až za mřížkou.
Jak jsme již řekli, AEC reguluje množství rtg záření, které dopadne na receptor obrazu. Před expozicí jsou nastaveny vstupní expoziční parametry – kV a mA, ať už manuálně nebo v rámci zvolené orgánové předvolby. AEC pak omezí celkovou hodnotu elektrického množství (mAs) dobou expozice, ale neovlivňuje kvalitu obrazu žádným jiným způsobem, např. tím, že by sama změnila hodnotu napětí.
Požadovaná hodnota záření dopadající na receptor obrazu se liší v závislosti na vyšetřované oblasti, indikaci, ale i v závislosti na napětí, energii a dávkovém příkonu. Obecně platí, že energie rtg fotonů ve spektru musí být dostatečná k tomu, aby fotony prošly vyšetřovanou oblastí v dostatečné míře, ale současně dostatečně nízká na to, aby byl v obraze zachován kontrast. Rtg vyšetření s vyšší hodnotou napětí poskytuje horší kontrast v obrazu (více zastoupen Comptonův rozptyl a méně fotoefekt), proto se zhoršuje i vnímaný poměr kontrastu a šumu. Pro dostatečnou, resp. podobně vnímanou, kvalitu obrazu jako v případě nižšího napětí je nutné získat méně šumu v obrazu. Toho lze dosáhnout vyšší dávkou, proto je přednastavená dávka na receptor obrazu vyšší. Naopak rtg vyšetření s nižší hodnotou napětí poskytuje dobrý kontrast, ale zvyšuje radiační zátěž pacienta, protože se spousta rtg fotonů pohltí v pacientovi, aniž by přispěla k tvorbě obrazu. Volba napětí by měla být právě kompromisem mezi kvalitou obrazu a radiační zátěží pacienta.
Nastavení AEC většinou probíhá před zahájením provozu nebo v průběhu používání při optimalizaci, prováděné např. kvůli stížnostem radiologů na špatnou kvalitu obrazu. Výrobci přednastavují AEC primárně na takové dávky, o kterých se domnívají, že jsou dostatečné pro použitý receptor obrazu.
Mějme vyšetřovaný objekt a přednastavenou hodnotu mA. S nižším napětím použitým pro expozici klesá i produkce rtg fotonů, méně jich projde vyšetřovanou oblasti a méně jich dopadne na receptor obrazu. Pro dosažení dostatečné dávky na receptoru obrazu při použití nižší hodnoty napětí je nutné významně prodloužit dobu expozice. Tento jev je již také zahrnut v nastavení AEC. Proto pro redukci pohybové neostrosti způsobené pacientem je žádoucí přednastavit, ať už manuálně nebo v rámci orgánové předvolby, nejvyšší hodnotu proudu (mA), čímž pak AEC může zkrátit expoziční čas pro dosažení stejné hodnoty mAs (z hlediska kvality obrazu je vždy lepší použít vyšší hodnotu mA a nižší hodnotu ms než naopak). Vyšší hodnoty mA vyžadují výkonnější rentgenku (rtg lampu), proto může být v některých případech vyšší hodnota mA limitována výkonem samotného rtg systému. Kvůli šetření rentgenky se většinou nevyužívá maximální možné hodnoty proudu, ale pouze přibližně 80 % maximální hodnoty. Konkrétní nastavení je řízeno mikroprocesorem tak, aby nedošlo ke zničení rentgenky.
V některých případech může dojít k tomu, že AEC neukončí expozici ani po určité době, např. při poruše AEC. V takovém případě je expozice ukončena po určitém čase bez ohledu na AEC. Tato hodnota je nastavena jako tzv. backup hodnota (záložní hodnota). Tato hodnota pak určuje i maximální hodnotu mAs, tedy i dávku, kterou pacient může obdržet za nejhorších podmínek, jako je právě zmíněná porucha AEC. Při poruše AEC, která není zjištěna obsluhujícími RA, se významně zvyšují dávky pacientům, což je velmi nežádoucí. Proto by RA měli mít vždy přehled o tom, jsou-li součásti zobrazovacího řetězce funkční.
Omezení existuje i z druhé strany, v některých případech je po ukončení expozice prostřednictvím AEC dávka na receptoru obrazu tak nízká, že receptor obrazu, častěji flat panel detektor, ani nemusí zaznamenat, že došlo k expozici. Typickým příkladem je rtg vyšetření srdce a plic, kdy se může stát, že pro 125 kV a proud cca 400 mA může být doba expozice okolo 1 ms. AEC proto musí být nastavena tak, aby i při krátkých expozičních časech umožňovala získání rtg obrazu dostatečné kvality.
Nastavení AEC musí být provedeno a optimalizováno pro všechny vyšetřovací protokoly a pro všechny možné kombinace technik a parametrů – pro různé orgánové předvolby, použité receptory obrazu (digitální detektory, CR), protirozptylové mřížky, filtrace, napětí, typy postprocessingu, případně i pro vyšetřovací protokoly rozdělené v závislosti na hmotnosti pacienta (pediatričtí pacienti vs. dospělí pacienti).
Nyní k některým konkrétním nastavením aktivních senzorů AEC. Při rtg vyšetření srdce a plic v předozadní projekci je aktivní pravý a levý senzor AEC, zatímco centrální je neaktivní. Je tedy sledováno množství záření, které projde přes oblast plic a dopadne na senzor AEC, ale není sledováno množství, které projde přes hrudní kost, jejíž pozice odpovídá centrálnímu senzoru AEC. Naopak při vyšetření v laterální projekci je aktivní pouze centrální senzor AEC.
Mimo velké vyšetřované objemy, jakými jsou hrudník, břicho, pánev, bederní páteř atd. a u kterých se používá AEC, se vyšetřují i menší objemy, jakými jsou typicky klouby, např. kotník, koleno, loket atd. Pro tato rtg vyšetření se AEC nepoužívá, senzory AEC nejsou aktivní. Důvodem je to, že při nastavení pozice vyšetřované oblasti na oblast senzorů nemusí dojít k tomu, že je senzor skutečně celý překrytý vyšetřovanou oblastí, ve které se záření zeslabí. AEC tak ukončí expozici dříve, než je dostatečně prozářena ona vyšetřovaná (současně zeslabující) část. Typickým příkladem je vyšetření prstů ruky, kdy se může stát, že prsty nepřekryjí celý senzor AEC. Rtg záření, které projde mezerou mezi prsty, ihned interaguje se senzorem AEC, který ukončí expozici, aniž by samotné prsty byly dostatečně prozářeny. Proto je nezbytné, aby u vyšetření menších objemů (kloubů) RA nastavil expoziční parametry, konkrétně napětí (kV) a elektrické množství (mAs), manuálně podle toho, jakou oblast vyšetřuje. K tomuto účelu opět velmi dobře slouží orgánové předvolby, které mají přednastavené hodnoty kV i mAs v závislosti na vyšetřovaném objemu a na velikosti pacienta (končetina dítěte vyžaduje jinou expozici než končetina obézního dospělého nebo končetina v sádře). U systémů bez orgánových předvoleb lze použít expoziční tabulky, které by pracoviště v případě absence orgánových předvoleb mělo mít vypracováno.
Většina rtg systémů je již vybavena měřičem dávky, tzv. KAP-metrem (DAP-metrem), který měří součin kermy (dávky) a plochy. Jedná se o transmisní planparalelní ionizační komoru (obr. 2), umístěnou ihned za výstupem rentgenky, která měří množství vyprodukovaného záření, na základě kterého pak lze odhadnout radiační zátěž pacienta. Tato ionizační komora však nemá nic společného s ionizačními komorami (senzory) AEC, tato dvě zařízení spolu nijak nesouvisejí, žádný z nich nezastává ani nenahrazuje funkci toho druhého. KAP-metr prostě jenom je a měří, co přes něj projde, ale žádným způsobem neusměrňuje expozici. V dnešní době je již většina rtg systémů vybavena jak AEC, tak i KAP-metrem.
 Obr. 2: KAP-metr (IBA Dosimetry: KermaX® plus TinO (Two in One) (iba-dosimetry.com))
Obr. 2: KAP-metr (IBA Dosimetry: KermaX® plus TinO (Two in One) (iba-dosimetry.com))
AEC se v současné době využívá u všech moderních rtg systémů, včetně angiografických a CT skenerů. U angiografických systémů s flat panel detektorem, u kterých se AEC označuje jako „Automatic Dose Rate Control“, se jedná o řízení 3-5 parametrů (v závislosti na výrobci). Mimo expoziční čas, zde označovaný jako délka pulzu, se jedná o nastavení napětí, proudu, velikosti ohniska a filtrace v závislosti na vyšetřované oblasti, konkrétně na jejím zeslabení (kolik záření se pohltí). U C-ramen se zesilovačem obrazu se jedná o „Automatic Brightness Control“, která prostřednictvím intenzity signálu na výstupu zesilovače obrazu mění expoziční parametry. U CT skenerů se AEC označuje jako „Automatic Tube Current Modulation“ a jedná se o modulaci proudu v závislosti na zeslabení vyšetřované oblasti. Zde se využívá dvojí modulace – modulace v podélném směru pacienta (zeslabení od hlavy přes ramena, hrudník, břicho a pánev se liší) a úhlové modulace (předozadní projekce vyžaduje méně záření než laterální projekce). Většina RA, radiologů i dalších lékařů používající denně rtg systémy, využívají AEC automaticky a práci bez ní si už téměř nedokážou představit.
Použitá literatura
- Dance DR, Christofides S, Maidment ADA, McLean ID, Ng KH. Diagnostic radiology physics: A handbook for teachers and students. International Atomic Energy Agency, Vienna, 2014. ISBN: 978-92-131010-1.
- Bushberg JT, Seibert JA, Leidholdt Jr E, Boone JM. The essential physics of medical imaging. 3rd ed., Lippincott Williams & Wilkins, 2012. ISBN 978-0-7817-8057-5.
- Sterling S. Automatic exposure control: A primer. Radiol Technol 1988; 59(5): 421-427.
- Dowsett DJ, Kenny PA, Johnston RE. The physics of diagnostic imaging. 2nd ed., Hodder Arnold, 2006. ISBN 978-0-340-80891-7.
- Radiology Key. Automatic exposure control. [cit. 30.1.2018]. Online dostupné na https://radiologykey.com/automatic-exposure-control/
- Jones KY. Using automatic exposure control in digital radiography. American Association of Physicists in Medicine. AAPM meeting 2008, Houston. [cit. 31.1.2018]. Online dostupné na https://www.aapm.org/meetings/amos2/pdf/35-9964-61632-988.pdf.
- TI-BA Enterprises. Dose-area product meter – KermaX plus TinO IDP. [cit. 31.1.2018]. Online dostupné na https://www.ti-ba.com/products/dap-meters/.
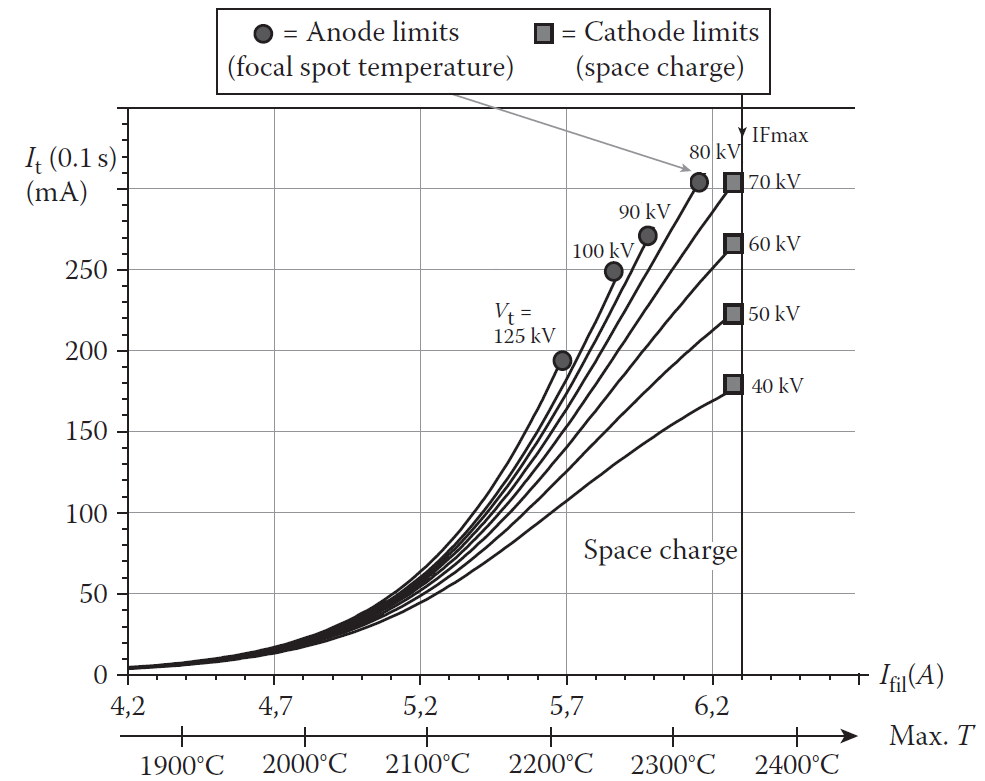 Obr. 1: Emisní charakteristika rentgenky
Obr. 1: Emisní charakteristika rentgenky

 Obr. 1: Gemstone detektorový systém s 3D kolimátorem
Obr. 1: Gemstone detektorový systém s 3D kolimátorem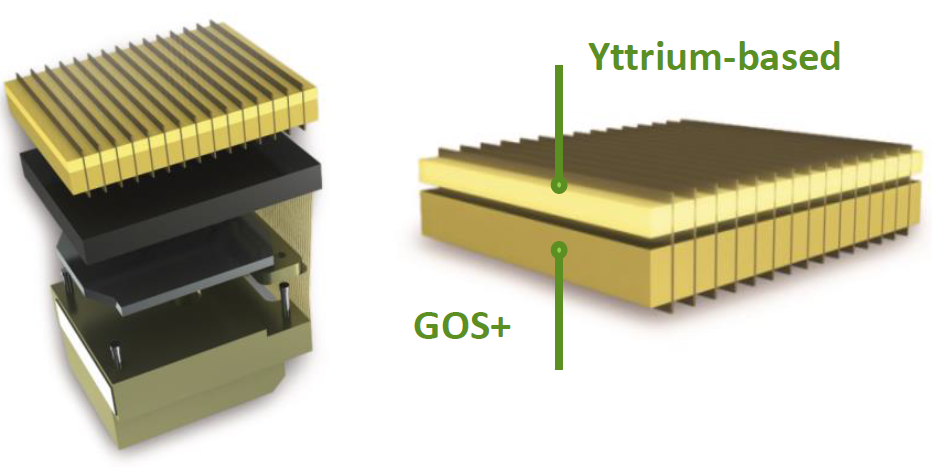 Obr. 2: Detekční modul spektrálního detektoru NanoPanel Prism
Obr. 2: Detekční modul spektrálního detektoru NanoPanel Prism Obr. 3: Detektor PURE VISION
Obr. 3: Detektor PURE VISION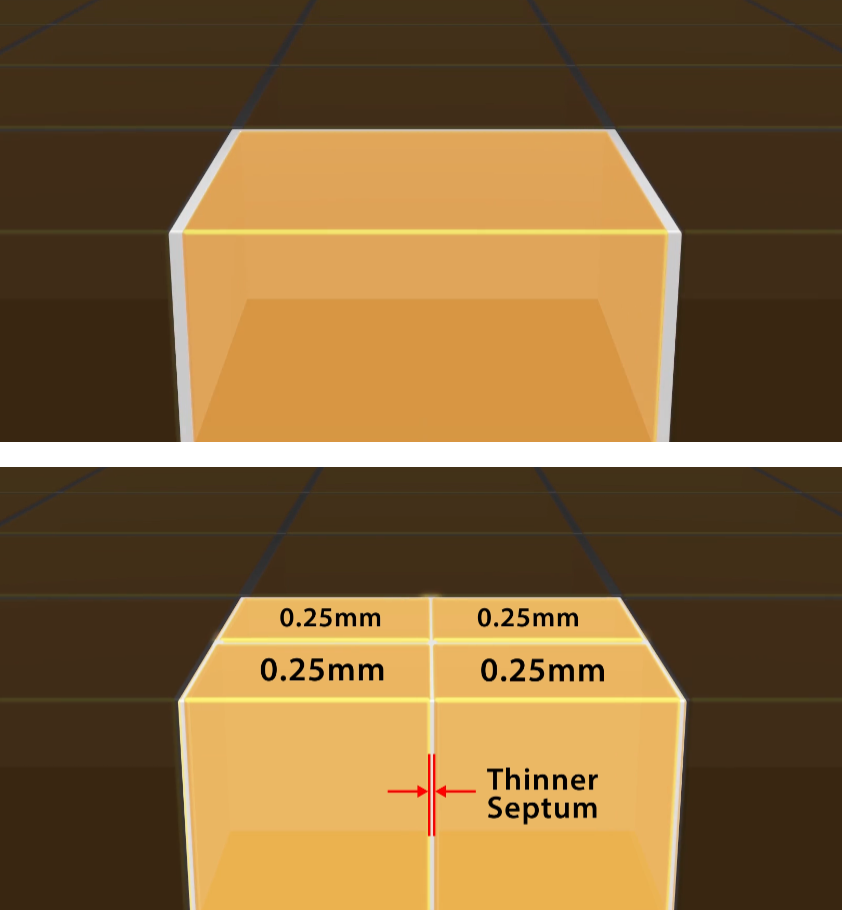 Obr. 4: Předchozí detektor PURE VISION a současný Ultra High Resolution
Obr. 4: Předchozí detektor PURE VISION a současný Ultra High Resolution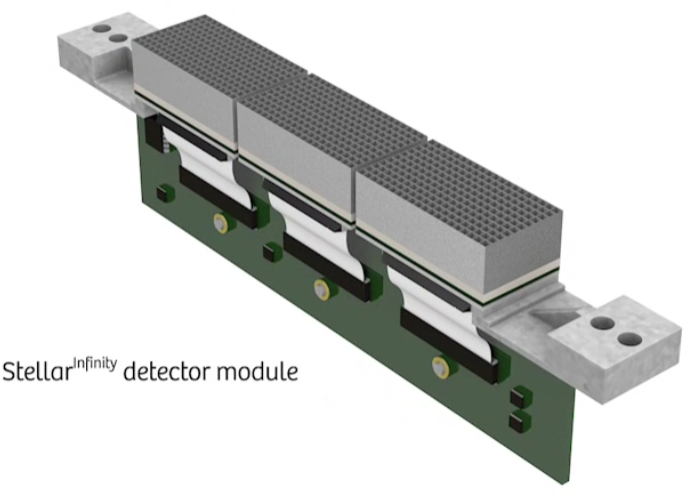 Obr. 5: Detekční modul Stellar Infinity
Obr. 5: Detekční modul Stellar Infinity
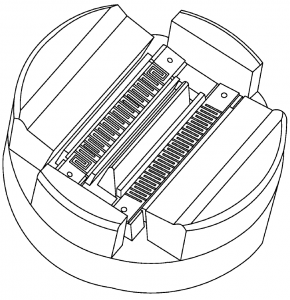 Obr. 1: Technologie flat emitter (z patentního dokumentu firmy GE)
Obr. 1: Technologie flat emitter (z patentního dokumentu firmy GE) Obr. 2: Ilustrace technologie flat emitter (žlutá oblast)
Obr. 2: Ilustrace technologie flat emitter (žlutá oblast) Obr. 3: Rentgenka Performix HD
Obr. 3: Rentgenka Performix HD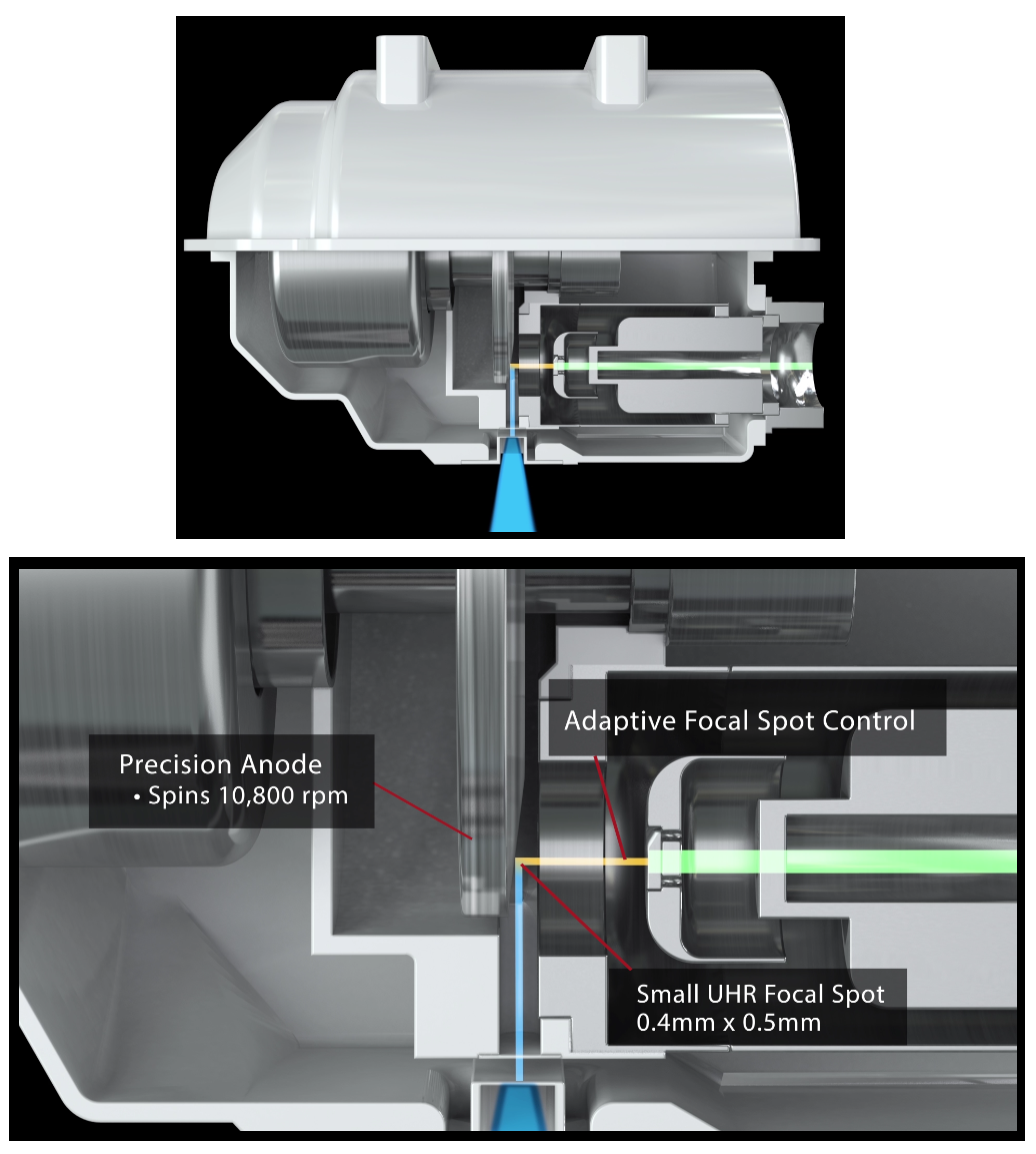 Obr. 4: Rentgenka pro ultra high resolution
Obr. 4: Rentgenka pro ultra high resolution Obr. 4: Rentgenka iMRC CT
Obr. 4: Rentgenka iMRC CT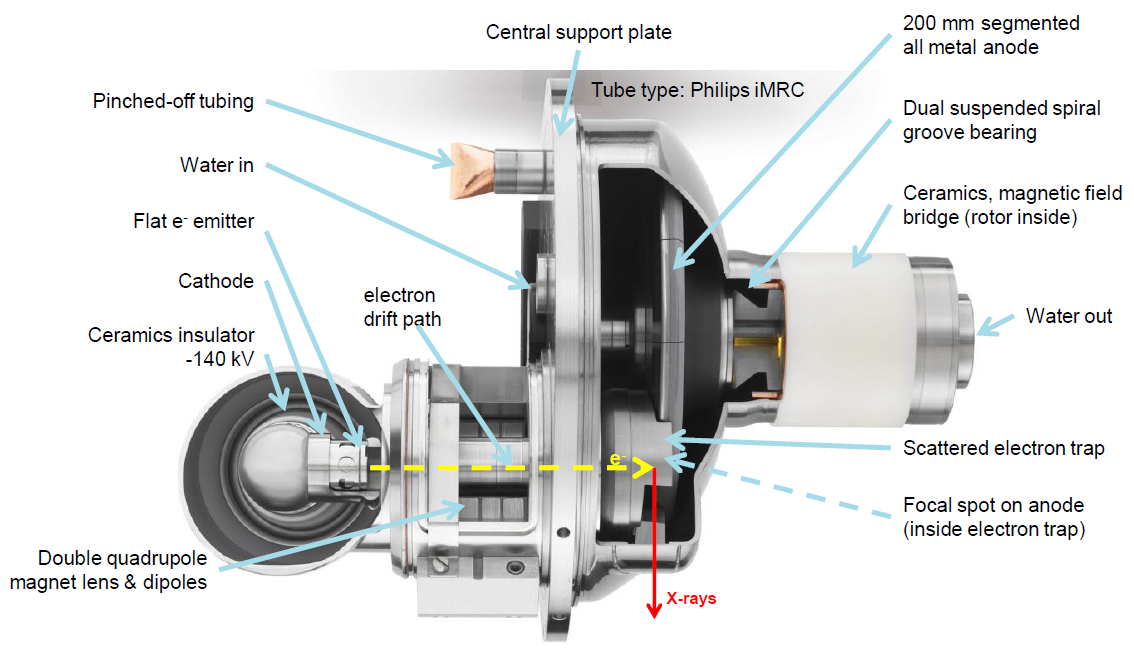 Obr. 5: Detailnější geometrie rentgenky iMRC CT (Philips)
Obr. 5: Detailnější geometrie rentgenky iMRC CT (Philips) Obr. 6: Rentgenka Vectron (Siemens)
Obr. 6: Rentgenka Vectron (Siemens)
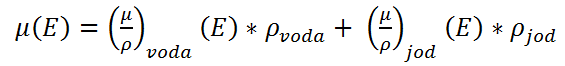 Tím, že dokážeme složení každého pixelu rozložit na zastoupení vody a jodu, je pak možné i z obrazu odečíst jod, čímž dostáváme tzv. virtuálně nekontrastní obraz (virtually non-contrast image). Mimo to je možné získat dosazením výrazu (1) do rovnice pro výpočet CT čísla (2), které se vyjádřuje v Hounsfieldových jednotkách (HU), výraz (3), na základě něhož lze zrekonstruovat tzv. monoenergetický obraz. Ten přibližně odpovídá tomu obrazu, který bychom dostali při použití spektra jakékoliv energie.
Tím, že dokážeme složení každého pixelu rozložit na zastoupení vody a jodu, je pak možné i z obrazu odečíst jod, čímž dostáváme tzv. virtuálně nekontrastní obraz (virtually non-contrast image). Mimo to je možné získat dosazením výrazu (1) do rovnice pro výpočet CT čísla (2), které se vyjádřuje v Hounsfieldových jednotkách (HU), výraz (3), na základě něhož lze zrekonstruovat tzv. monoenergetický obraz. Ten přibližně odpovídá tomu obrazu, který bychom dostali při použití spektra jakékoliv energie.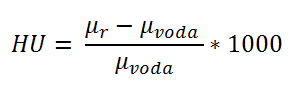 (3)
(3)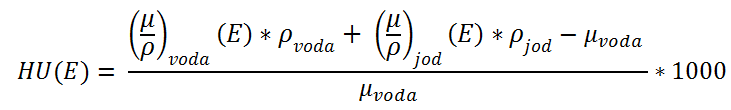 Zobrazení monoenergetického obrazu se využívá při popisu různých obrazů, např. obraz pro nižší energie (45-55 keV) se používá při popisu měkkých tkání, kdy chceme získat vysoký kontrast mezi lézí a okolními tkáněmi. Obraz středních energií (60-75 keV) se využívá při popisu angiografie. A obraz s vyššími energiemi (95-140 keV) se používá při popisu obrazu, u kterého jsou významné artefakty z kovových implantátů, protože vyšší energií lze docílit redukce těchto artefaktů.
Zobrazení monoenergetického obrazu se využívá při popisu různých obrazů, např. obraz pro nižší energie (45-55 keV) se používá při popisu měkkých tkání, kdy chceme získat vysoký kontrast mezi lézí a okolními tkáněmi. Obraz středních energií (60-75 keV) se využívá při popisu angiografie. A obraz s vyššími energiemi (95-140 keV) se používá při popisu obrazu, u kterého jsou významné artefakty z kovových implantátů, protože vyšší energií lze docílit redukce těchto artefaktů.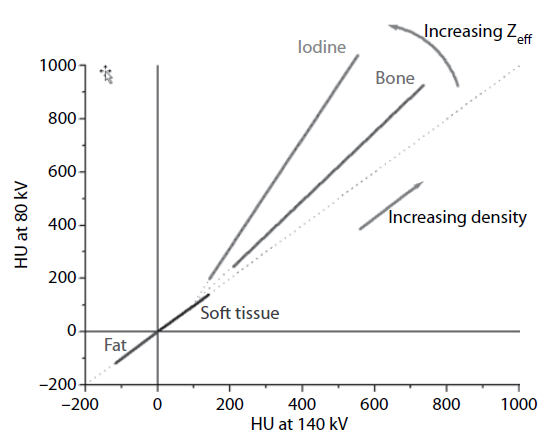 Obr. 1: Závislost HU(80) na HU(140)
Obr. 1: Závislost HU(80) na HU(140)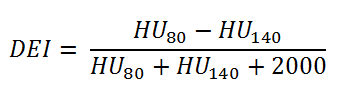 Ze znalosti DEI lze usuzovat na chemické složení tkání. Hodnoty DEI pro některé tkáně jsou následující:
Ze znalosti DEI lze usuzovat na chemické složení tkání. Hodnoty DEI pro některé tkáně jsou následující: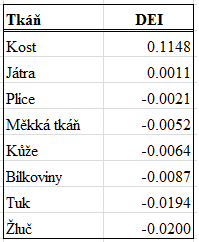
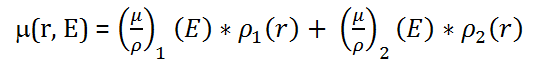 kde indexem 1 je označen první materiál a indexem 2 druhý materiál. Hmotnostní součinitel zeslabení (µ/ρ)_i ve voxelu r je lineární kombinací zastoupení fotoefektu a Comptonova rozptylu pro tento materiál i a je závislý na energii. ρ_i je hustota daného materiálu. Rovnici (1) lze zjednodušeně přepsat jako:
kde indexem 1 je označen první materiál a indexem 2 druhý materiál. Hmotnostní součinitel zeslabení (µ/ρ)_i ve voxelu r je lineární kombinací zastoupení fotoefektu a Comptonova rozptylu pro tento materiál i a je závislý na energii. ρ_i je hustota daného materiálu. Rovnici (1) lze zjednodušeně přepsat jako: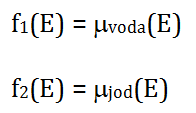
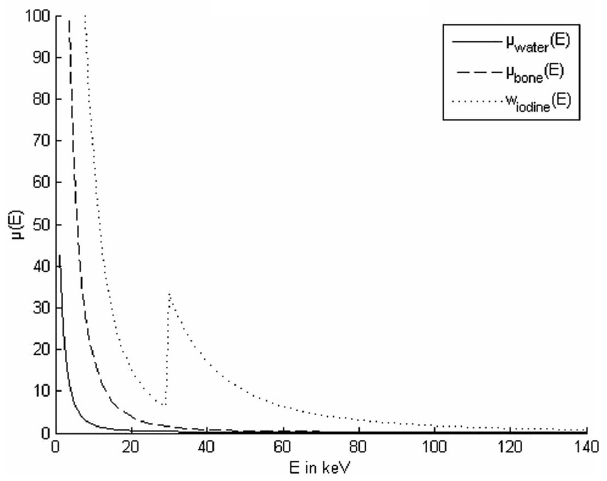 Obr. 1: Součinitele zeslabení pro vodu, kost a jód
Obr. 1: Součinitele zeslabení pro vodu, kost a jód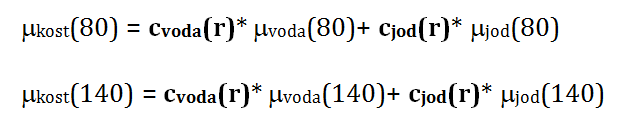 Výsledek dekompozice pro jeden voxel může být např. toto:
Výsledek dekompozice pro jeden voxel může být např. toto: Obr. 1: Fantom s nízkokontrastními a vysokokontrastními objekty
Obr. 1: Fantom s nízkokontrastními a vysokokontrastními objekty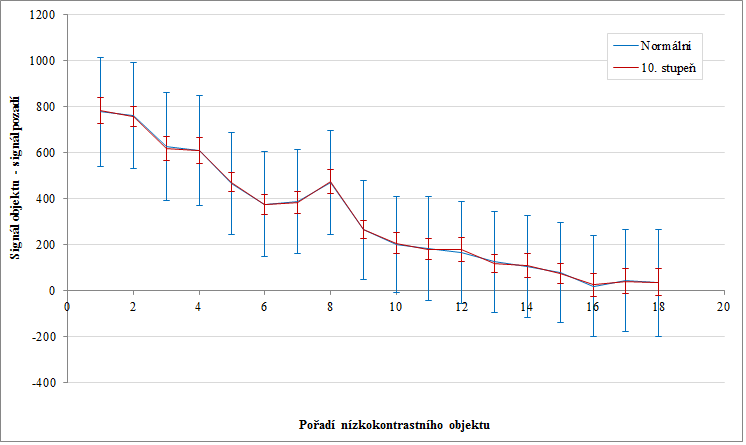 Obr. 2: Signál nízkokontrastních objektů se směrodatnou odchylkou pro normální obraz a obraz s 10. stupněm vyhlazení
Obr. 2: Signál nízkokontrastních objektů se směrodatnou odchylkou pro normální obraz a obraz s 10. stupněm vyhlazení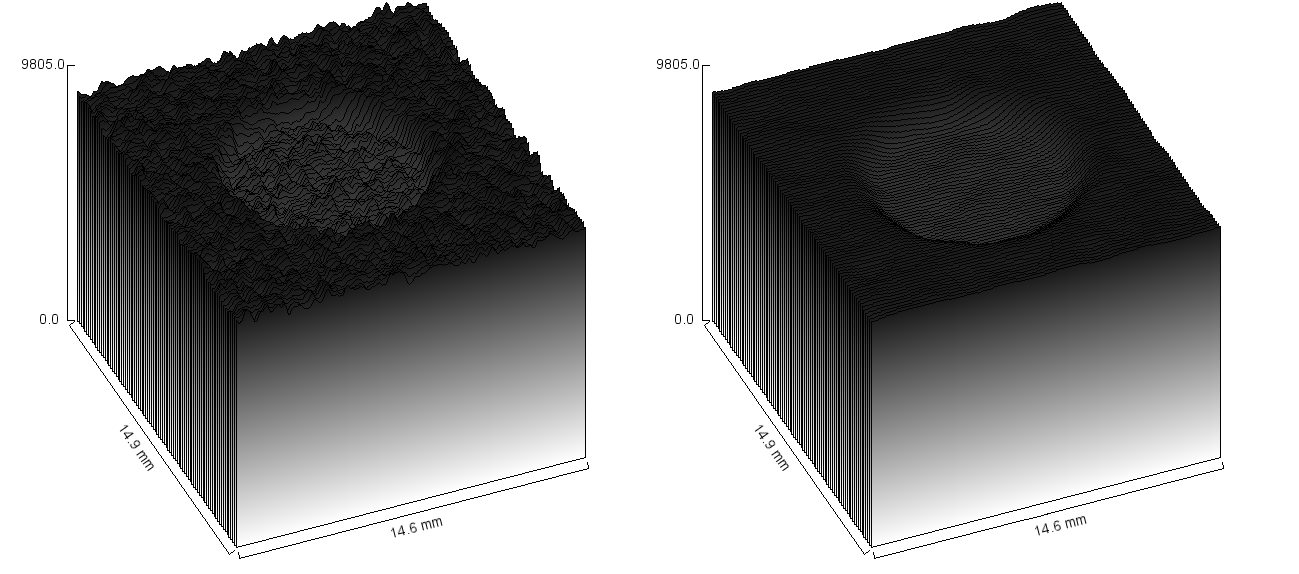 Obr. 3: 3D zobrazení prvního nízkokontrastního objektu pro normální obraz a obraz s 10. stupněm vyhlazení
Obr. 3: 3D zobrazení prvního nízkokontrastního objektu pro normální obraz a obraz s 10. stupněm vyhlazení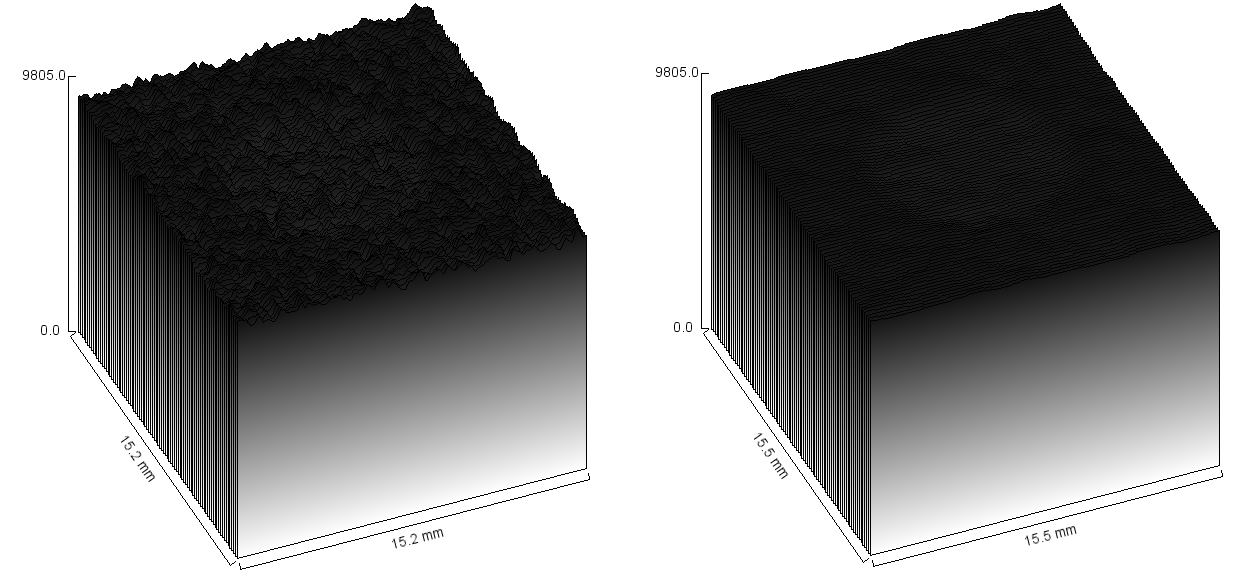 Obr. 4: 3D zobrazení desátého nízkokontrastního objektu pro normální obraz a obraz s 10. stupněm vyhlazení
Obr. 4: 3D zobrazení desátého nízkokontrastního objektu pro normální obraz a obraz s 10. stupněm vyhlazení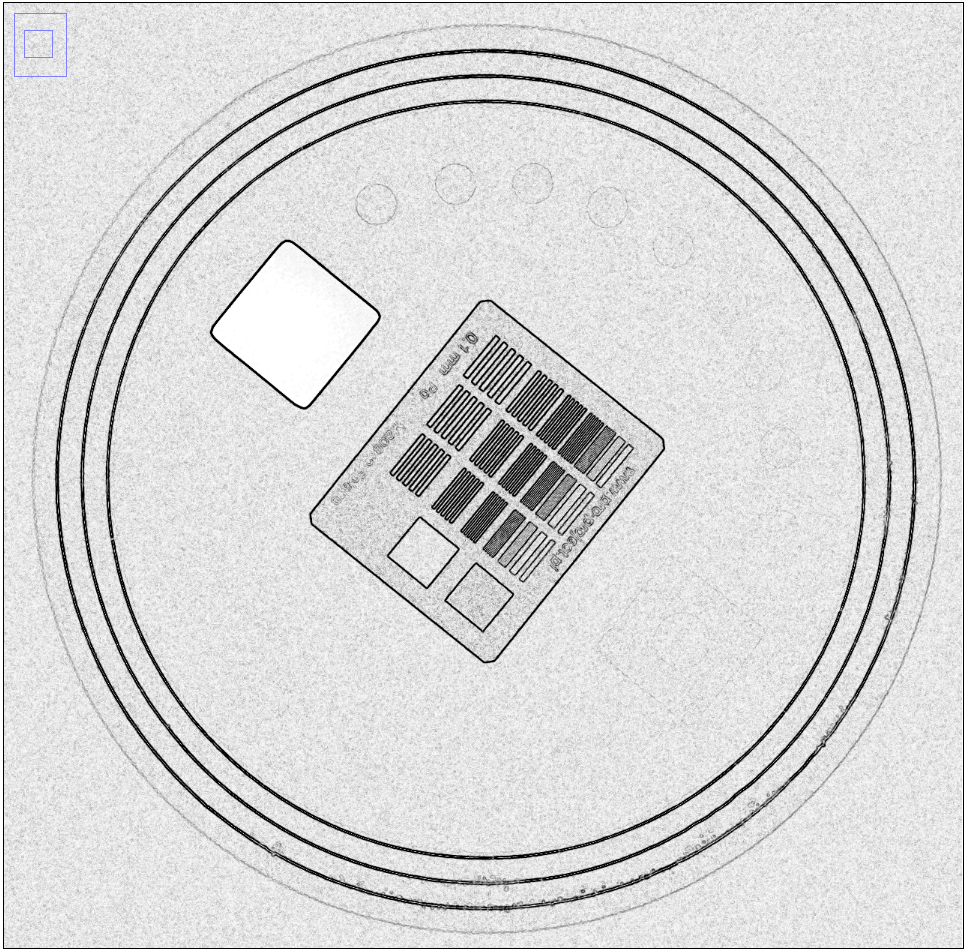 Obr. 5: Hrany obrazu
Obr. 5: Hrany obrazu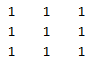 Výsledná hodnota v každém pixelu je pak průměrem okolních bodů pixelu. Lze použít taktéž matici s pěti sloupci a s pěti řádky. Čím větší je rozměr konvoluční matice, tím je i vyhlazení výraznější.
Výsledná hodnota v každém pixelu je pak průměrem okolních bodů pixelu. Lze použít taktéž matici s pěti sloupci a s pěti řádky. Čím větší je rozměr konvoluční matice, tím je i vyhlazení výraznější. Matice pro zvýraznění hran vypadá následovně:
Matice pro zvýraznění hran vypadá následovně: Použitá literatura
Použitá literatura Obr. 2: Normální obraz (nahoře vlevo), 1. stupeň ostření (nahoře vpravo), 2. stupeň ostření (dole vlevo), 3. stupeň ostření (dole vpravo)
Obr. 2: Normální obraz (nahoře vlevo), 1. stupeň ostření (nahoře vpravo), 2. stupeň ostření (dole vlevo), 3. stupeň ostření (dole vpravo)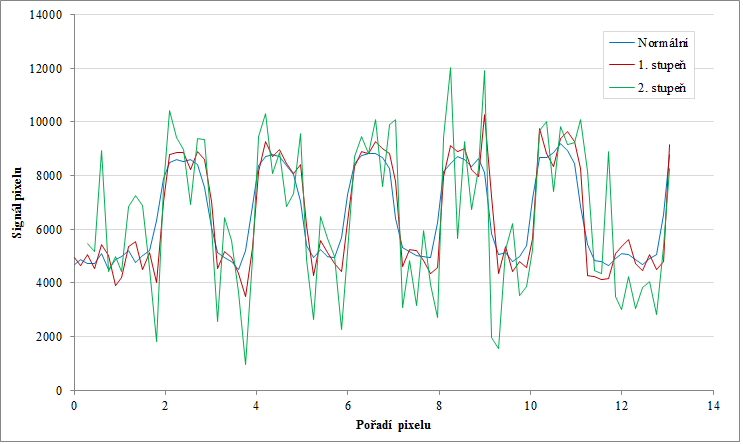 Obr. 3: Profily podél červených čar pro normální obraz a dva stupně ostření
Obr. 3: Profily podél červených čar pro normální obraz a dva stupně ostření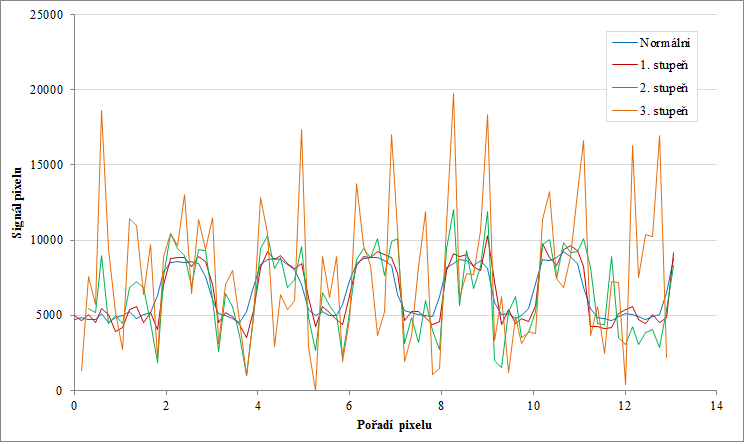 Obr. 4: Profily podél červených čar pro normální obraz a tři stupně ostření
Obr. 4: Profily podél červených čar pro normální obraz a tři stupně ostření Obr. 5: Normální obraz (nahoře vlevo), 2. stupeň vyhlazení (nahoře vpravo), 5. stupeň vyhlazení (dole vlevo), 10. stupeň vyhlazení (dole vpravo)
Obr. 5: Normální obraz (nahoře vlevo), 2. stupeň vyhlazení (nahoře vpravo), 5. stupeň vyhlazení (dole vlevo), 10. stupeň vyhlazení (dole vpravo)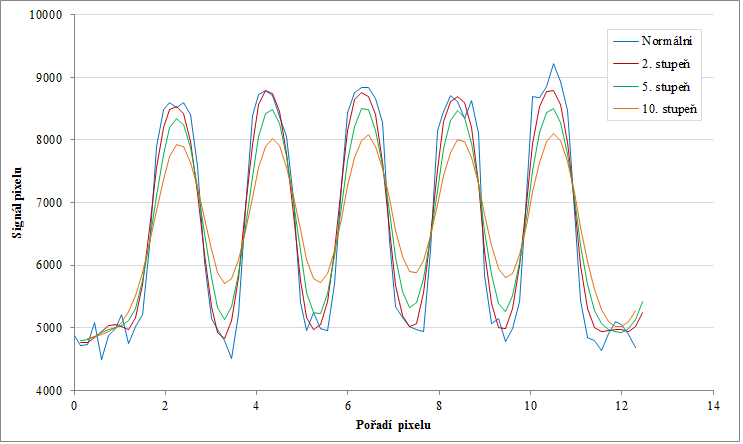 Obr. 6: Profily podél kratších červených čar pro normální obraz a několik stupňů vyhlazení
Obr. 6: Profily podél kratších červených čar pro normální obraz a několik stupňů vyhlazení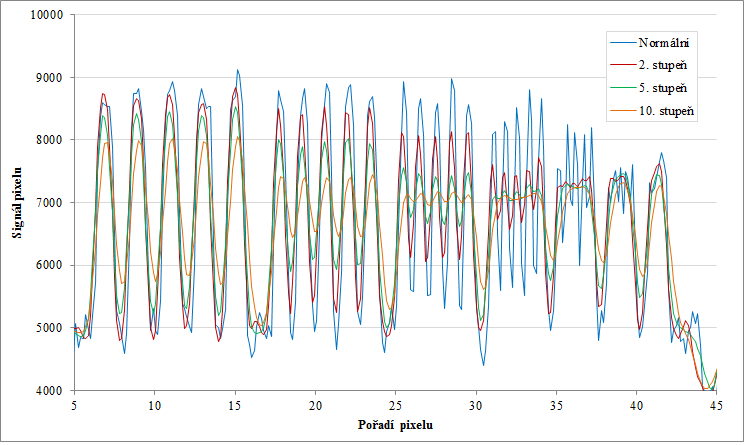 Obr. 7: Profily podél delších červených čar pro normální obraz a několik stupňů vyhlazení
Obr. 7: Profily podél delších červených čar pro normální obraz a několik stupňů vyhlazení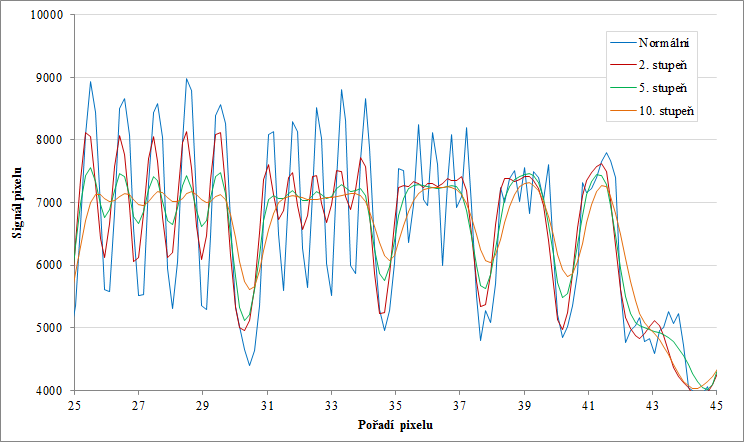 Obr. 8: Profily podél delších červených čar pro normální obraz a několik stupňů vyhlazení od pixelu 25 dále (část obr. 7)
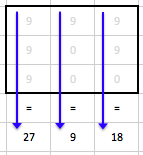
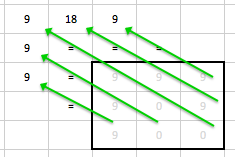
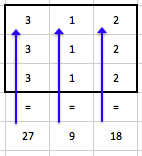
Obr. 8: Profily podél delších červených čar pro normální obraz a několik stupňů vyhlazení od pixelu 25 dále (část obr. 7)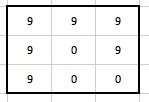




 Obr. 1: Ukázka nových CT skenerů [1]
Obr. 1: Ukázka nových CT skenerů [1] Obr. 2: Ukázka nových CT rentgenek [1]
Obr. 2: Ukázka nových CT rentgenek [1]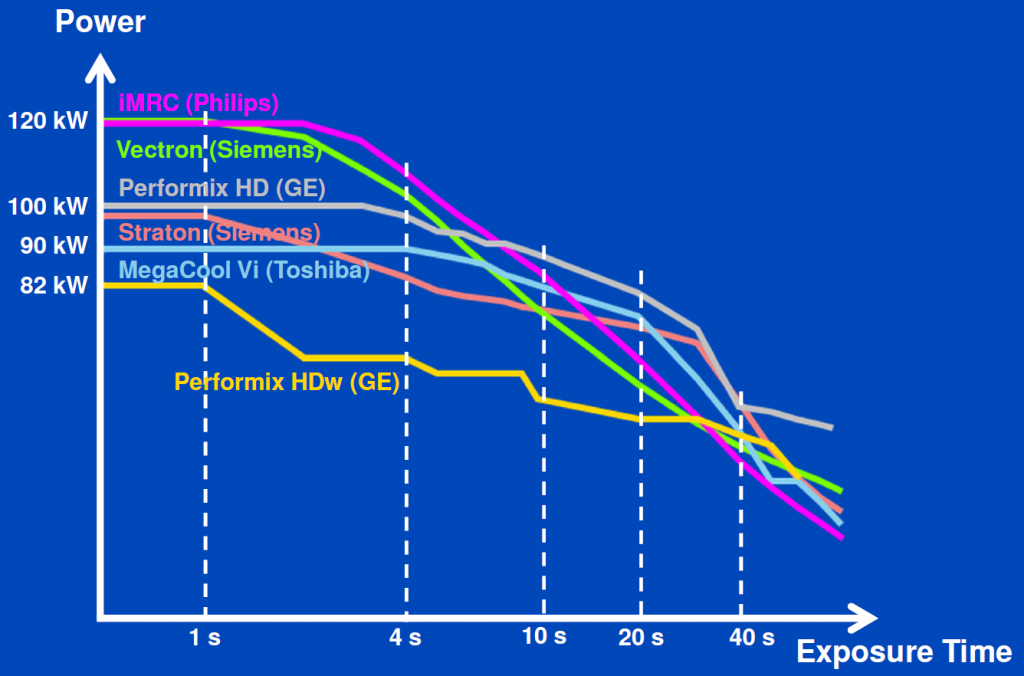 Obr. 3: Výkon CT rentgenek při napětí 120 kV [1]
Obr. 3: Výkon CT rentgenek při napětí 120 kV [1]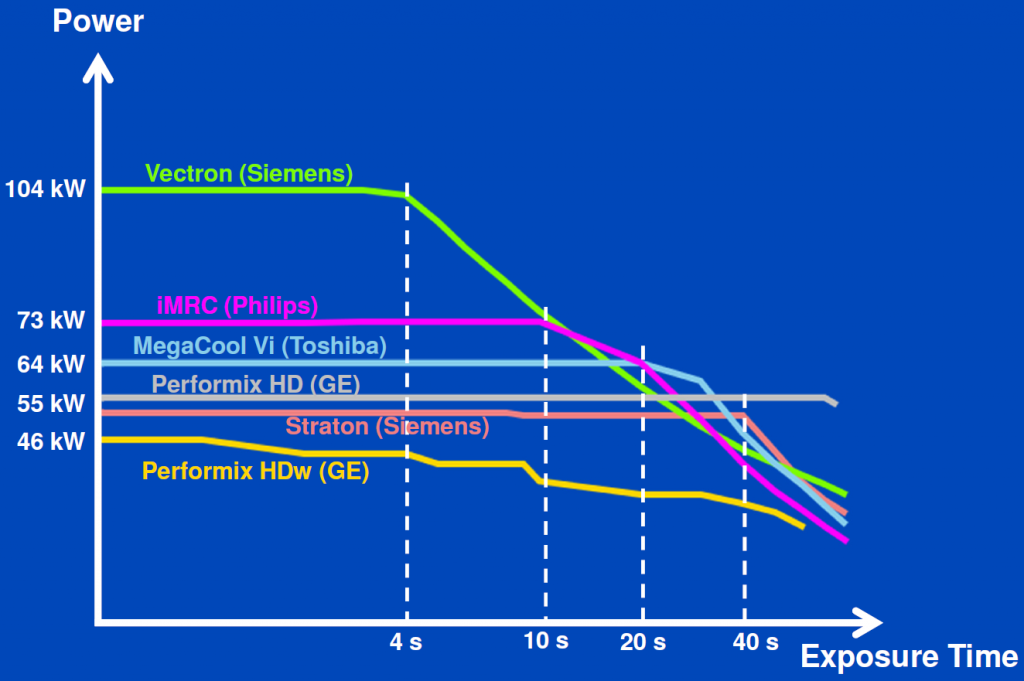 Obr. 4: Výkon CT rentgenek při napětí 80 kV [1]
Obr. 4: Výkon CT rentgenek při napětí 80 kV [1]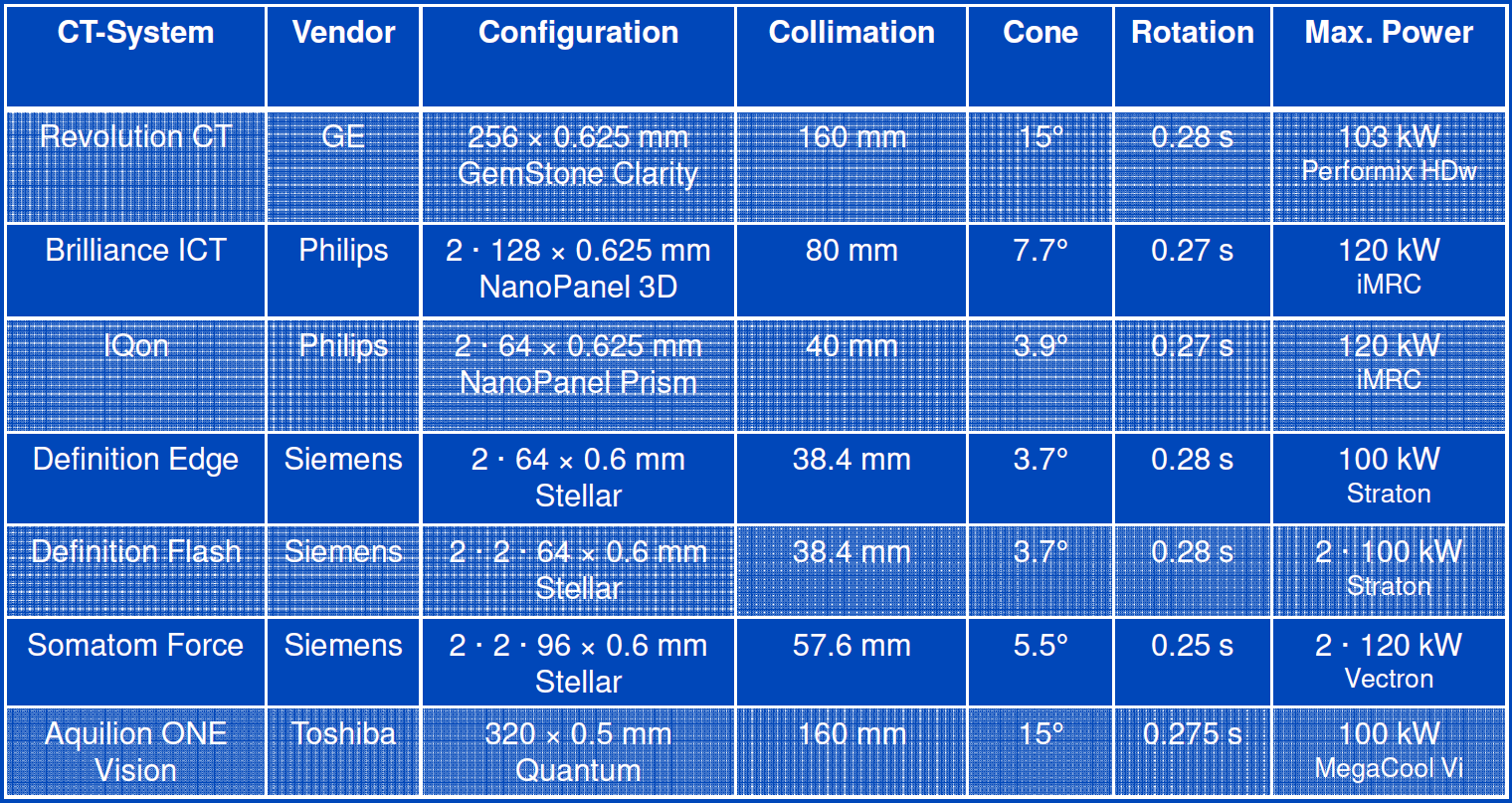 Tab. 1: Souhrn parametrů nových CT skenerů [1]
Tab. 1: Souhrn parametrů nových CT skenerů [1]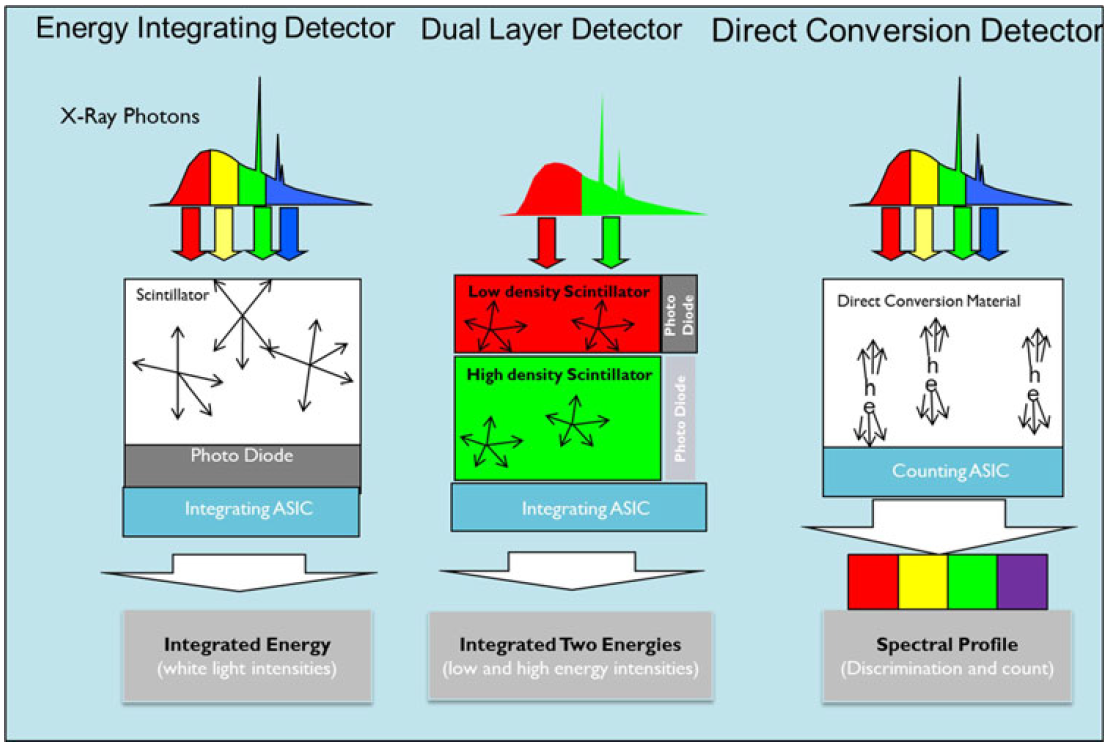
 Obr. 1: Matice CT detektorů (Philips) [1]
Obr. 1: Matice CT detektorů (Philips) [1] Obr. 2: Scintilační materiál CT detektoru (Philips) [1] – scintilační materiál (nažloutlá barva) jednotlivých detekčních elementů je oddělen odrazivými vrstvami (bílá barva) pro minimalizaci cross-talku
Obr. 2: Scintilační materiál CT detektoru (Philips) [1] – scintilační materiál (nažloutlá barva) jednotlivých detekčních elementů je oddělen odrazivými vrstvami (bílá barva) pro minimalizaci cross-talku Obr. 3: Matice diod, která je připevněna na výstupní stranu scintilačního materiálu (Philips) [1]
Obr. 3: Matice diod, která je připevněna na výstupní stranu scintilačního materiálu (Philips) [1]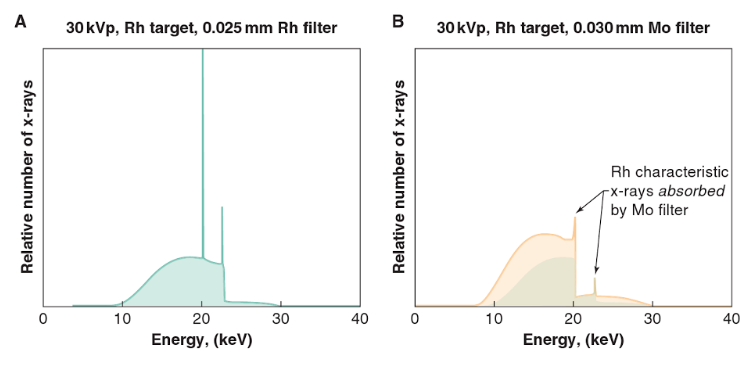 a) Pouze spektrum uvedené vlevo je použitelné klinicky
a) Pouze spektrum uvedené vlevo je použitelné klinicky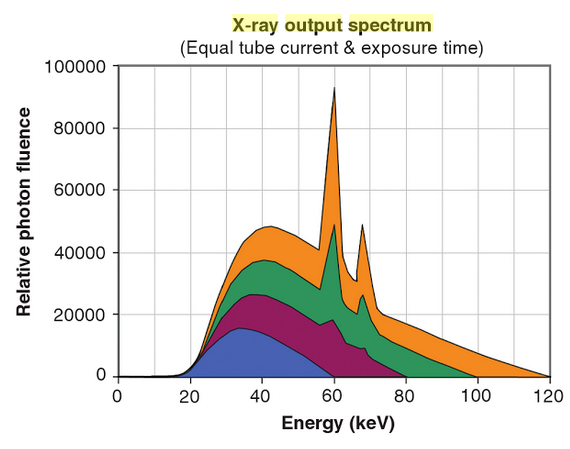 a) mA
a) mA a) kV
a) kV
 a) Zjištění senzitivity a linearity
a) Zjištění senzitivity a linearity
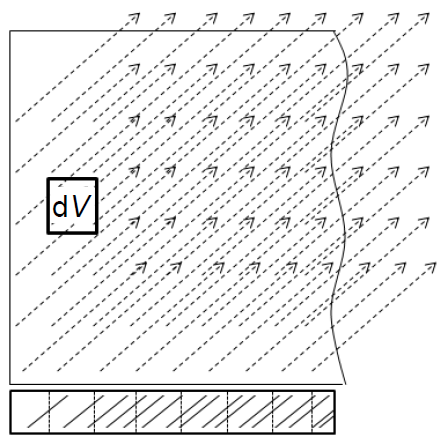 Obr. 1: Znázornění rovnováhy nabitých částic [1]
Obr. 1: Znázornění rovnováhy nabitých částic [1]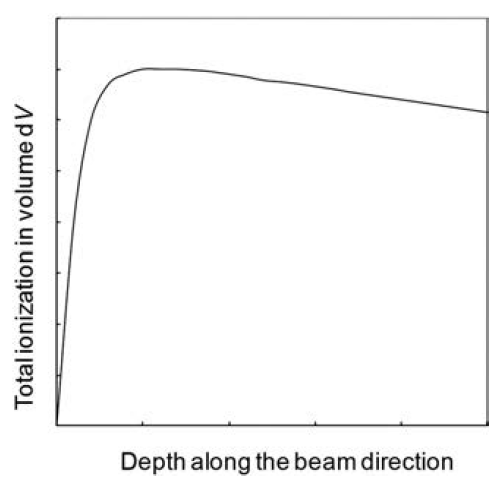 Obr. 2: Celková ionizace v závislosti na hloubce [1]
Obr. 2: Celková ionizace v závislosti na hloubce [1]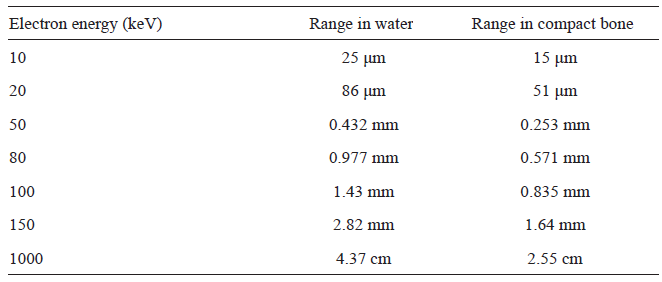 Tab. 1: Dosah elektronů různých energií ve vodě a v kompaktní kosti [1]
Tab. 1: Dosah elektronů různých energií ve vodě a v kompaktní kosti [1]
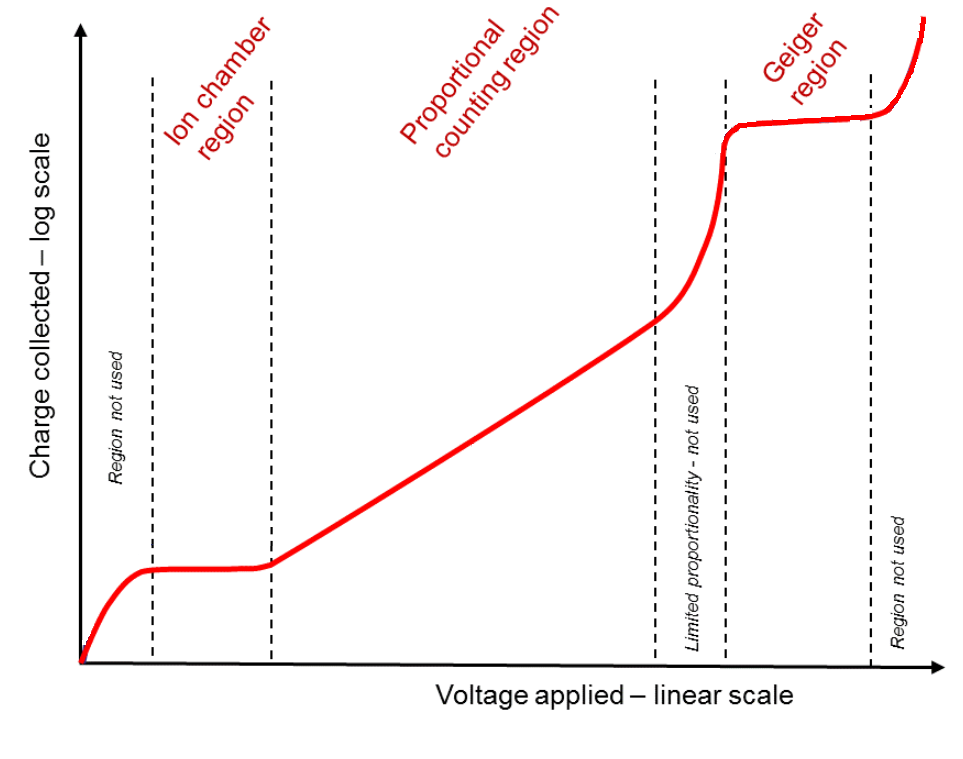 Obr. 1: Pracovní oblasti různých typů plynových detektorů (sebraný náboj na elektrodách v závislosti na intenzitě elektrického pole, tedy elektrickém potenciálu mezi elektrodami)
Obr. 1: Pracovní oblasti různých typů plynových detektorů (sebraný náboj na elektrodách v závislosti na intenzitě elektrického pole, tedy elektrickém potenciálu mezi elektrodami)