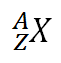Každý atom je definovaný počtem svých protonů v jádře, vyjádřeným protonovým číslem Z, někdy nazývaným atomovým číslem. V elektricky neutrálním atomu odpovídá počet protonů v jádře počtu elektronů v elektronovém obalu. Neboli protonové číslo Z udává současně počet elektronů.
Mimo protonové číslo je atom definovaný celkovým počtem nukleonů v jádře. Mezi nukleony se počítají protony a neutrony. Počet nukleonů je vyjádřen nukleonovým číslem A. Standardní zápis protonového a nukleonového čísla u atomu X je následující:
Nukleonové číslo A se uvádí jako horní index, protonové číslo Z jako dolní index. Protonové číslo někdy není nutné uvádět, protože prvek je jednoznačně definovaný již chemickou značkou.
Obecně se však vyskytují atomy daného prvku s různým počtem nukleonů, počet protonů je u těchto atomů stejný (jedná se o atomy stejného prvku), liší se počtem neutronů. Takové atomy označujeme jako izotopy. Izotopy jsou atomy se stejným počtem protonů, ale s různým počtem neutronů (~nukleonů).
Dále existují tzv. izotony, což jsou atomy s různým protonovým číslem (nejedná se tedy o atomy stejného prvku), ale se stejným počtem neutronů.
Izobary jsou atomy různých prvků, které mají stejné nukleonové číslo, tj. atomy se liší počtem protonů, i počtem neutronů, ale součet počtu protonů a neutronů mají shodný.
Mimo izotopy, izotony a izobary existují ještě izomery. Izomery jsou atomy jednoho prvku se stejným protonovým a nukleonovým číslem, liší se pouze energetickým stavem.