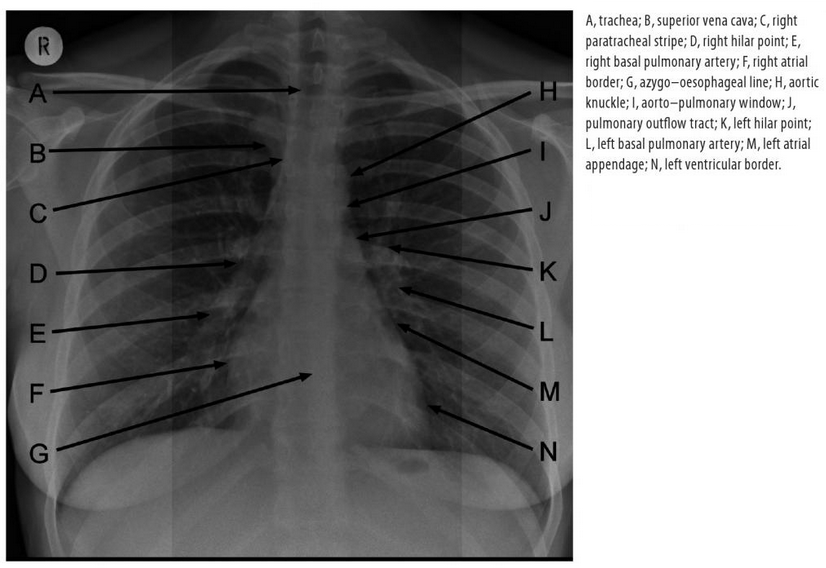
Mezi komponenty zobrazovacího řetězce CT skeneru, které mají bezesporu největší dopad na kvalitu obrazu, patří zdroj záření, detekční systém a rekonstrukční algoritmus. V tomto a příštím článku se zaměříme na první dvě komponenty, zdroj a detekční systém.
V posledních dvaceti letech se vývoj CT detektorů řídil třemi hlavními trendy: zvyšováním počtu řezů, které souvisí s pokrytím většího skenovaného objemu, zvyšováním rychlosti skenu, která souvisí s větším výkonem zdroje a s kratšími dobami potřebnými k vyhodnocení signálu, a redukcí dávek, které velmi těsně souvisí s použitím iterativní rekonstrukce.
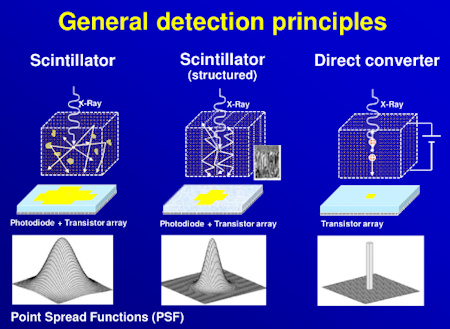
Jako CT detektory se v současnosti používají scintilační detektory, které mají detekční účinnost téměř 100%, zatímco dříve používané plynové detektory (xenonem plněné ionizační komory) měly účinnost pouze okolo 70%.
Scintilační detektory se skládají ze tří hlavních částí, dalo by se říct i vrstev. První vrstvou je scintilační materiál, který převádí energii detekovaných rtg fotonů na fotony viditelného světla. Další vrstvu tvoří fotodiody, na které dopadají vzniklé fotony viditelného světla, jejichž energie je převedena na elektrický signál. Třetí vrstvu představuje substrát pro přenesení elektrického signálu k elektronice k zesílení a dalšímu zpracování.
Matice detektorů se skládá z malých detekčních elementů. Rozpětí matice detektorů v axiální rovině pacienta je cca 1 m. Ukázka takové matice detektorů s tloušťkou 8 cm v podélné ose pacienta je na obr. 1. Na obr. 2 je ukázka scintilačního materiálu pro 64-řadý detektor. Scintilační materiál jednotlivých detekčních elementů je od sebe oddělen odrazivými vrstvami (septy) pro minimalizaci prostorového cross-talku (cross-talk je jev, kdy je světlo z jedné interakce zaznamenáno i v sousedních scintilačních elementech, nikoliv pouze v tom jednom, kde došlo k interakci, udává se v procentech celkového signálu). Na obr. 3 je pak ukázka matice diod, které jsou připevněny ke scintilačnímu materiálu.
 Obr. 1: Matice CT detektorů (Philips) [1]
Obr. 1: Matice CT detektorů (Philips) [1]
 Obr. 2: Scintilační materiál CT detektoru (Philips) [1] – scintilační materiál (nažloutlá barva) jednotlivých detekčních elementů je oddělen odrazivými vrstvami (bílá barva) pro minimalizaci cross-talku
Obr. 2: Scintilační materiál CT detektoru (Philips) [1] – scintilační materiál (nažloutlá barva) jednotlivých detekčních elementů je oddělen odrazivými vrstvami (bílá barva) pro minimalizaci cross-talku
 Obr. 3: Matice diod, která je připevněna na výstupní stranu scintilačního materiálu (Philips) [1]
Obr. 3: Matice diod, která je připevněna na výstupní stranu scintilačního materiálu (Philips) [1]
Vlastnosti detektoru jsou klíčové pro získání CT obrazu dostatečné kvality. Zejména jde o dynamický rozsah (signál v detekčních elementech se může lišit až o 4 řády, CT detektory mají rozsah cca 5 řádů), rychlost odezvy, prostorové rozlišení, geometrickou detekční účinnost, kvantovou detekční účinnost a cross-talk (prostorový i časový, většinou několik procent), ale také o stabilitu (dlouhodobou i krátkodobou, kdy CT detektory musí produkovat stejnou odezvu na stejné ozáření) a homogenitu.
Geometrická detekční účinnost (geometric detection efficiency, GDE) je poměr mezi množstvím rtg fotonů dopadajících na aktivní oblast detektoru a celkovým množstvím dopadajících rtg fotonů. Závisí zejména na tzv. fill-faktoru (poměr mezi aktivní plochou detektoru a celkovou plochou detektoru, neaktivní plocha je plocha, kterou zaujímá elektronika). Typicky se pohybuje okolo 70%.
Kvantová detekční účinnost (detective quantum efficiency, DQE) je poměr mezi druhou mocninou SNR (signal to noise ratio) na výstupu detektoru SNRout a druhé mocniny SNR na vstupu detektoru SNRin. Většina zdrojů uvádí DQE pouze ve spojitosti se skiagrafií (radiografií), kdy výsledný obraz přímo souvisí s kvalitou detektoru. DQE klesá s klesající dávkou, protože se významně uplatňuje elektronický šum. Pro ideální detektor platí, že DQE=1.
Celková detekční účinnost (detection efficiency) detektoru je pak dána součinem geometrické a kvantové detekční účinnosti:
DE = GDE*DQE.
DQE však může být charakterizováno také jinak, a to pomocí noise power spektra, modulační přenosové funkce a signálu z plochy detektoru, jak bylo ukázáno v jednom z předešlých článků.
Použitá literatura
[1] Shefer E, Altman A, Behling R, Goshen R, Gregorian L, Roterman Y, Uman I, Wainer N, Yagil Y, Zarchin O. State of the art of CT detectors and sources: A literature review. Curr Radiol Rep. 2013; 1: 76-91.
[2] International Atomic Energy Agency. Diagnostic Radiology Physics: A Handbook for Teachers and Students. International Atomic Energy Agency, 2014.
 Obr. 1: Rekonstrukce filtrovanou zpětnou projekcí (vlevo) a iterativní rekonstrukcí SAFIRE se sílou 1, 3 a 5 (síla 5 na obr. úplně vpravo)
Obr. 1: Rekonstrukce filtrovanou zpětnou projekcí (vlevo) a iterativní rekonstrukcí SAFIRE se sílou 1, 3 a 5 (síla 5 na obr. úplně vpravo)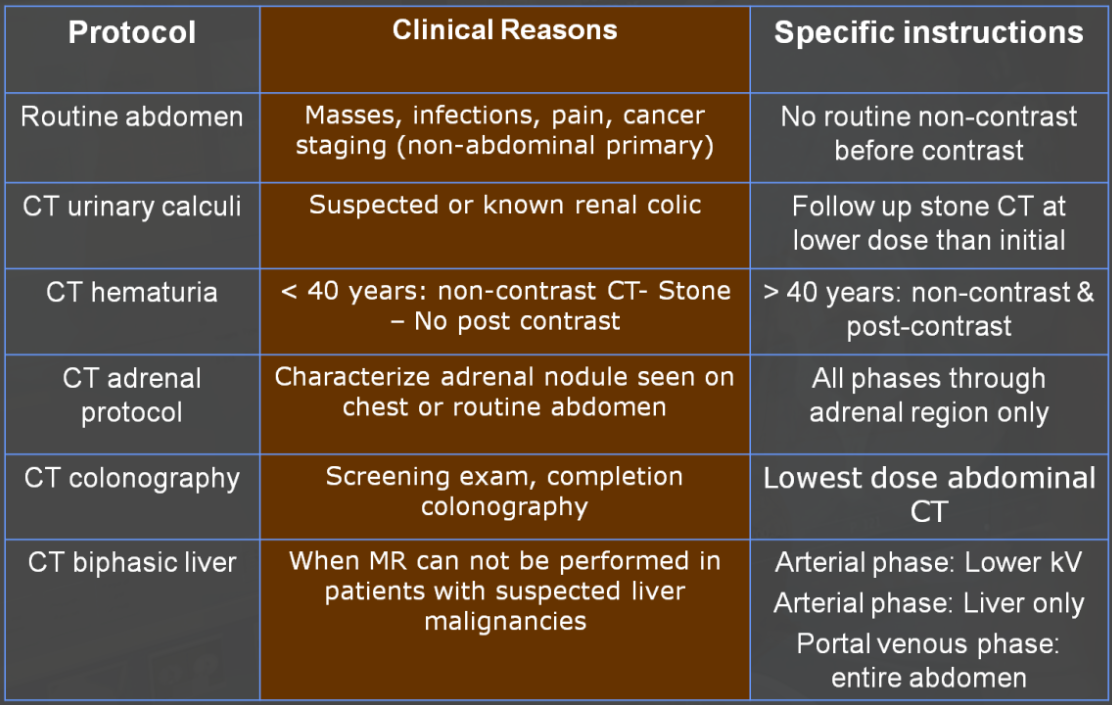 Obr. 2: Ukázka CT protokolů břicha
Obr. 2: Ukázka CT protokolů břicha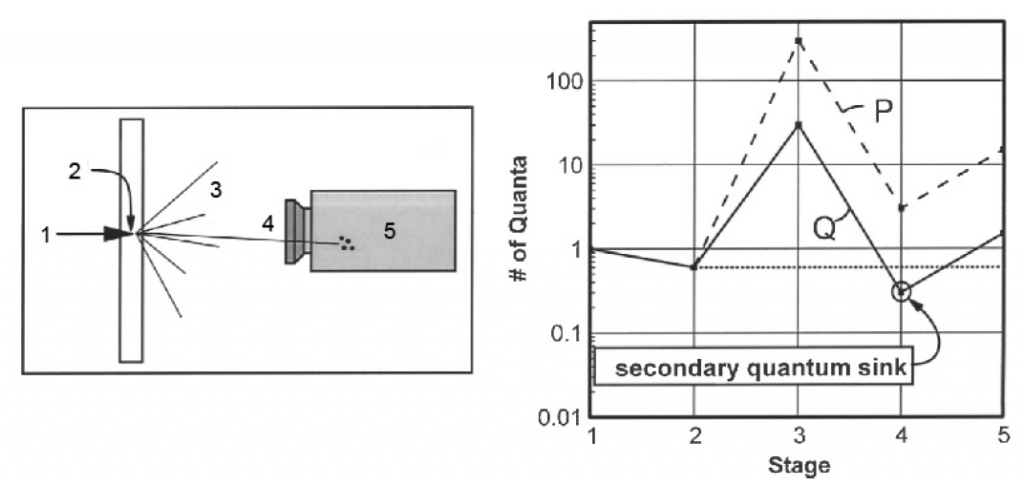 Obr. 1: Kroky při detekci záření (vlevo) a množství vznikajících kvant (vpravo)
Obr. 1: Kroky při detekci záření (vlevo) a množství vznikajících kvant (vpravo)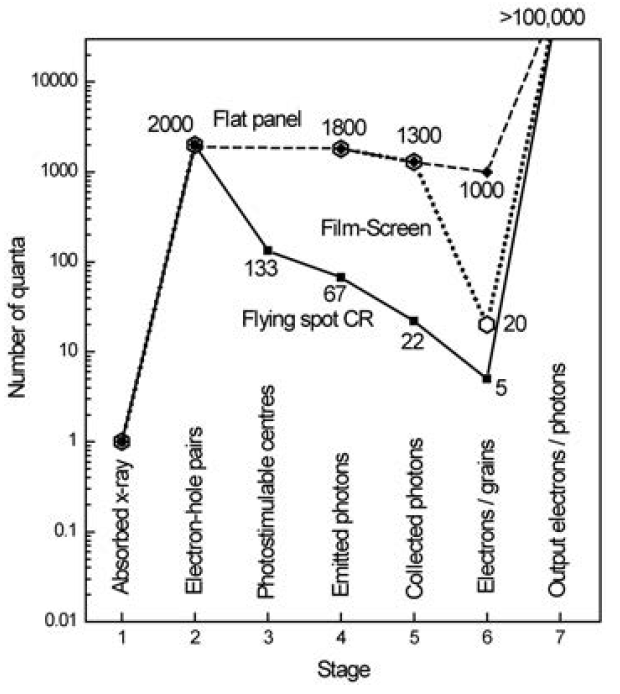
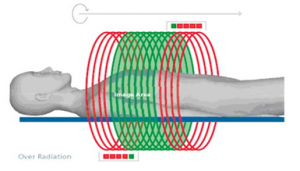 Obr. 1: Ukázka adaptivního stínění (Siemens)
Obr. 1: Ukázka adaptivního stínění (Siemens)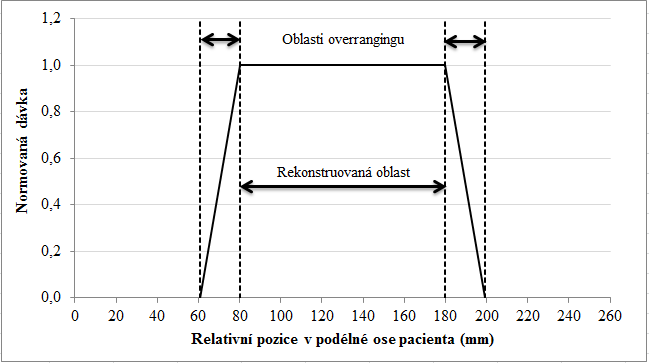 Obr. 1: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 38,4 mm
Obr. 1: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 38,4 mm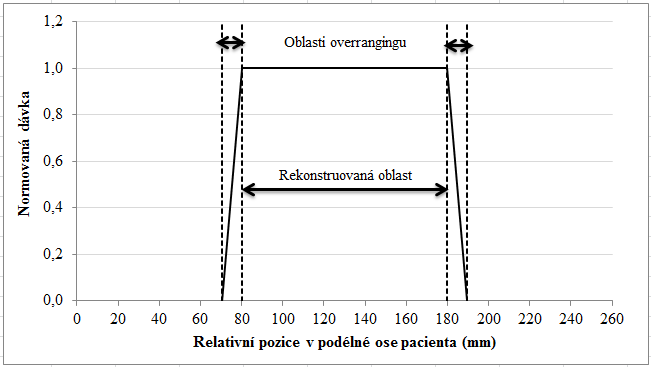 Obr. 2: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 19,2 mm
Obr. 2: Ukázka rekonstruované oblasti a oblasti overrangingu pro celkovou kolimaci 19,2 mm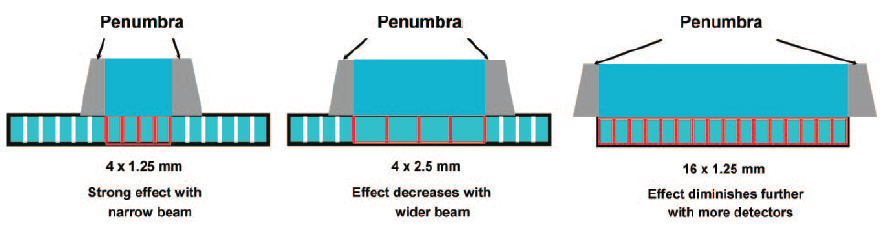 Obr. 3: Ukázka overbeamingu (šedou barvou) u různých skenů
Obr. 3: Ukázka overbeamingu (šedou barvou) u různých skenů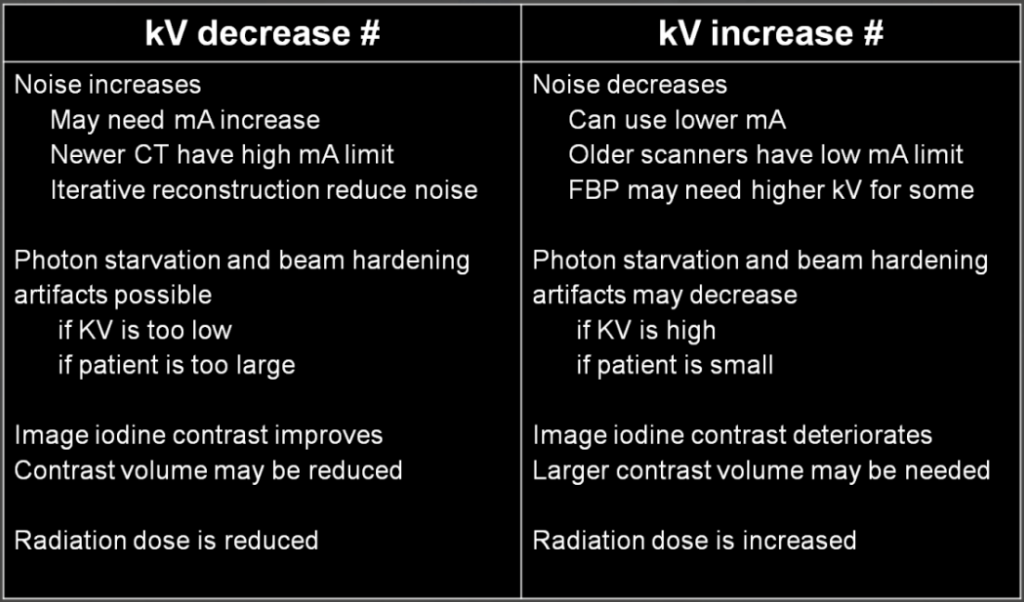 Obr. 1: Změny vyvolané použitím nižšího a vyššího napětí
Obr. 1: Změny vyvolané použitím nižšího a vyššího napětí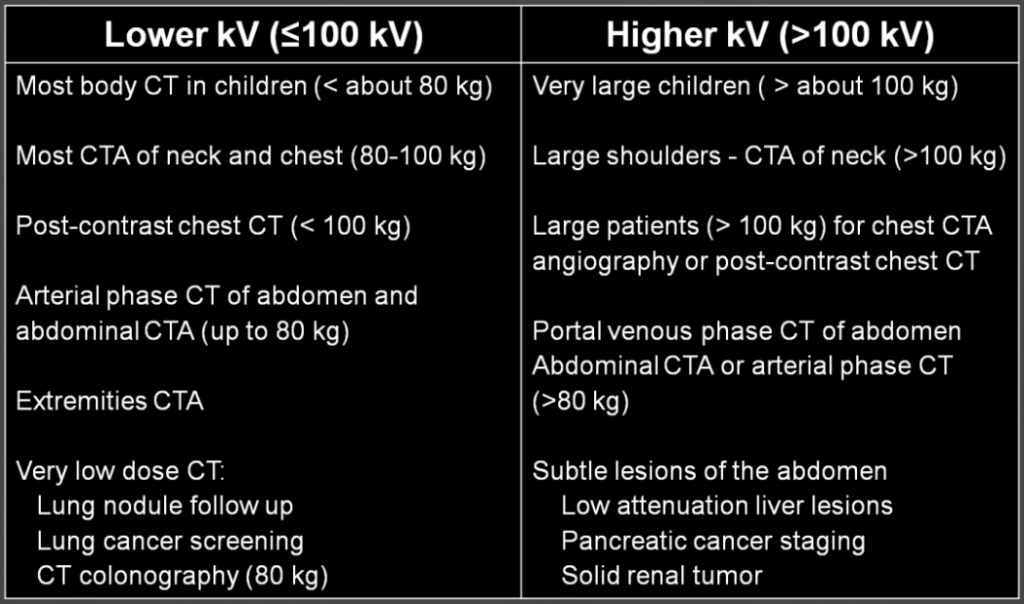 Obr. 2: Doporučení pro napětí 100 kV a méně a pro více než 100 kV
Obr. 2: Doporučení pro napětí 100 kV a méně a pro více než 100 kV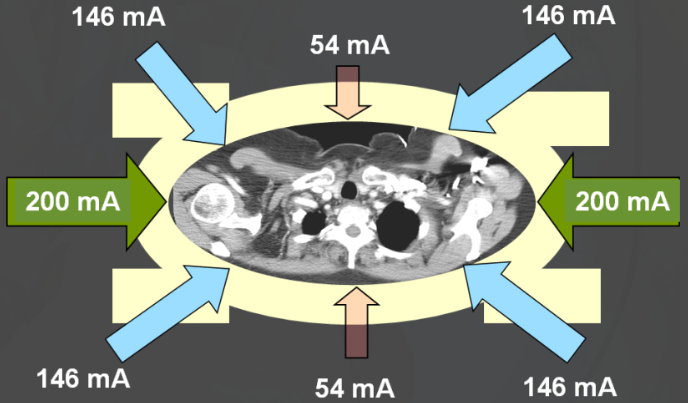 Obr. 1: Ukázka úhlové modulace proudu (proud se pohybuje v rozmezí hodnot 54 – 200 mA v závislosti na profilu zeslabení v daném směru)
Obr. 1: Ukázka úhlové modulace proudu (proud se pohybuje v rozmezí hodnot 54 – 200 mA v závislosti na profilu zeslabení v daném směru)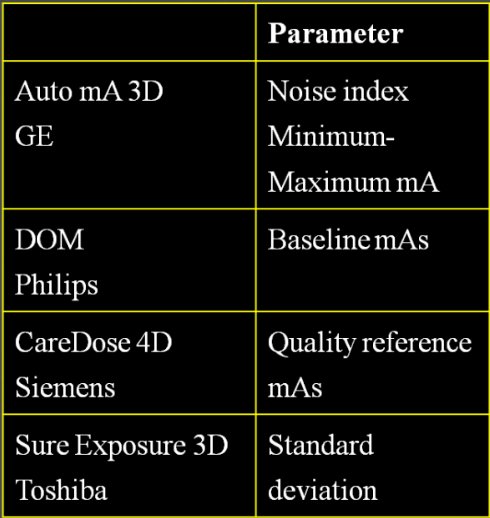 Obr. 2: Přehled parametrů udávajících kvalitu obrazu na CT
Obr. 2: Přehled parametrů udávajících kvalitu obrazu na CT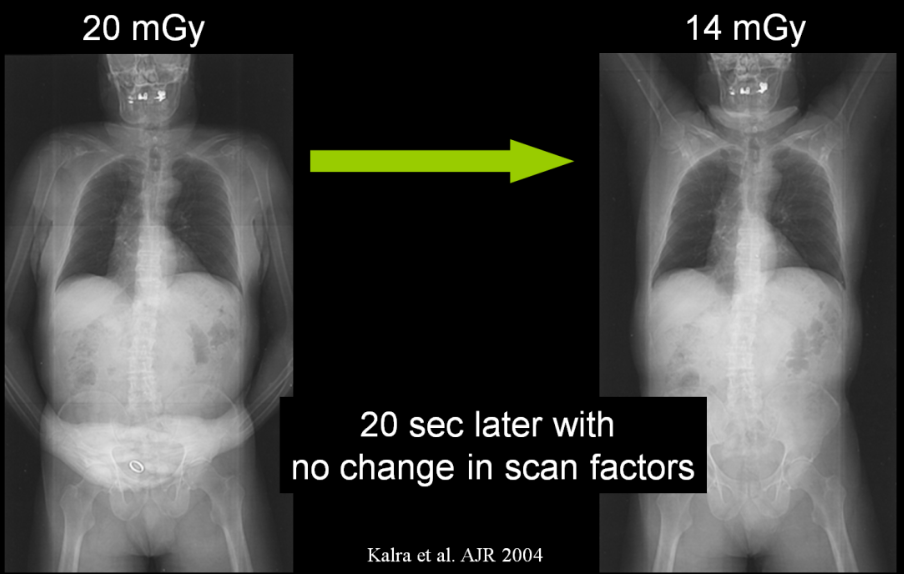 Obr. 3: CT topogram – vlevo paže podél těla, vpravo paže nad hlavou
Obr. 3: CT topogram – vlevo paže podél těla, vpravo paže nad hlavou